Принцип действия акб
Устройство и принцип работы автомобильного аккумулятора | Полезные статьи
Понравилось видео? Подписывайтесь на наш канал!Автомобиль в наше время перестал быть роскошью и стал средством передвижения. Многих автомобилистов интересуют такие вопросы, как: какие автомобильные аккумуляторы лучшие, устройство автомобильного аккумулятора и принцип его работы. Сегодня в нашей статье мы ответим на эти вопросы, а также расскажем, можно ли зарядить автомобильный аккумулятор.
Устройство автомобильного аккумулятора
Автомобильный аккумулятор состоит из следующих элементов:
• Корпус и крышка из эбонита или кислотостойкого пластика. На крышке располагаются специальные отверстия, через которые заливается электролит и осуществляется дальнейшая дозаливка дистиллированной воды. Заливные отверстия закрываются пробками из полиэтилена, имеющими вентиляционные отверстия для выхода газов при эксплуатации.
• Полюсные выводы – отрицательный и положительный. Для того чтобы не перепутать полярность, выводы имеют разные диаметры (у положительного он больше), а также могут иметь гравировку «+» и «-». Это исключает возможность неправильного подключения электропотребителей к АКБ.
Под крышкой аккумулятора размещаются:
• Аккумуляторная батарея, состоящая из шести аккумуляторов или, как их еще называют, банок. Банки помещены в электролит – раствор, состоящий из 35% серной кислоты и 65% дистиллированной воды. Электролит необходим для взаимодействия химических элементов и вырабатывания электрического тока.
• Борны, предназначенные для наружного токоотвода. К ним привариваются положительный и отрицательный полюсные выводы.
• Перегородки, обеспечивающие разделение блоков аккумуляторов (банок) друг от друга.
• Полюсные мосты с межэлементными соединителями, при помощи которого выполняется герметичное соединение блоков аккумуляторов через перегородку корпуса.
Банки же в свою очередь состоят из следующих частей:
• Блок положительных электродов, выполненный из свинцовых решетчатых пластин, на которые нанесена активная масса из диоксида свинца. Все электроды через ушко подсоединены к полюсному мосту.
• Блок отрицательных электродов из свинцовых решетчатых пластин, в которые впрессована активная масса из мелкопористого свинца. Электроды через ушко, так же подсоединены к соответствующему полюсному мосту.
Стоит отметить, что количество реагента, нанесенного на пластины положительных и отрицательных электродов, определяет такую важную характеристику аккумуляторной батареи, как ее емкость, а площадь поверхности пластин — пусковой ток.
• Сепаратор. Чаще всего представляет собой конверт из мипора, мипласта или полиэтилена. Он обеспечивает разделение участвующих в электрохимических превращениях реагентов, а также обеспечивает возможность диффузии электролита от одного электрода к другому.
Принцип работы аккумуляторной батареи
Принцип действия аккумулятора основан на образовании разности потенциалов между двумя электродами, погруженными в электролит. При подключении нагрузки к аккумулятору активное вещество на положительных и отрицательных электродах вступает в химическую реакцию с электролитом, который частично диссоциирован на положительные и отрицательные ионы. Под действием ЭДС аккумулятора электрический ток потечет по направлению от положительного электрода к отрицательному. Электроны, накопившиеся на отрицательном электроде, будут перетекать по внешней цепи в противоположном направлении. Электроны, двигаясь по сеткам электродов, будут вырабатывать электрический ток, при этом в одной банке формируется напряжение около двух Вольт. После того как электроны из первой банки проходят во вторую, они набирают еще два Вольта. Далее все повторяется, пока напряжение автомобильного аккумулятора на выходе не составит 12 Вольт.
Важно отметить, что во время разрядки происходит окислительная реакция, которая приводит к образованию на пластинах электродов сульфата свинца и к истощению электролита.
Чтобы выполнить заряд автомобильного аккумулятора, к его борнам необходимо присоединить источник тока, напряжение которого превышает ЭДС аккумулятора. Ток будет протекать через аккумулятор в направлении, обратном току разряда. Электроны будут перетекать от отрицательных электродов к положительным, при этом так же будет восстанавливаться ионный состав электролита.
Как правило, считается, что чем больше емкость АКБ, тем лучше. Однако следует отметить, что при выборе аккумуляторной батареи для своего авто нужно учитывать рекомендации производителя по емкости и напряжению. А значит, «правильный» автомобильный аккумулятор тот, который подобран в соответствии с требуемыми характеристиками.
Мы рассказали об устройстве и принципе работы аккумуляторной батареи. Вы также можете посмотреть наше видео, в котором подробно показано, как устроен АКБ и как она работает.
Принцип работы свинцово-кислотного аккумулятора.
Аккумуляторные батареи
Принцип работы свинцового аккумулятора
Источником электроэнергии на автомобиле при неработающем или работающем с малой частотой вращения коленчатого вала двигателе является аккумуляторная батарея. В настоящее время на автомобилях наиболее широко применяются свинцовые аккумуляторные батареи, состоящие из нескольких последовательно соединенных аккумуляторов. Применение кислотных аккумуляторов объясняется тем, что они обладают небольшим внутренним сопротивлением и способны в течение короткого промежутка времени (несколько секунд) отдавать ток силой в несколько сотен ампер, что необходимо для питания стартера при пуске двигателя.
Свинцовый аккумулятор электрической энергии был изобретен в 1859 году французским физиком Гастоном Планте. В последующие годы конструкция аккумулятора, особенно – химический состав его электродов (пластин) постоянно совершенствовалась. В настоящее время свинцовые аккумуляторы и аккумуляторные батареи широко применяются в разных областях техники в качестве накопителей электроэнергии (стартерные батареи, аварийные и резервные источники энергии и т. п.).
Конструктивно аккумулятор представляет собой емкость, наполненную электролитом, в которой размещены свинцовые электроды. В качестве электролита используется раствор серной кислоты и дистиллированной воды. Электроды выполнены в виде пластин, одна из которых изготовлена из губчатого свинца Pb, а вторая – из диоксида свинца PbO2. При взаимодействии электродов с электролитом между ними возникает разность потенциалов.
Принцип работы свинцово-кислотных аккумуляторов основан на электрохимических реакциях свинца и диоксида свинца в водном растворе серной кислоты.
При подключении к электродам аккумулятора внешней нагрузки начинается электрохимическая реакция взаимодействия оксида свинца и серной кислоты, при этом металлический свинец окисляется до сульфата свинца.
Во время разряда происходит восстановление диоксида свинца на положительном электроде (аноде) и окисление свинца на отрицательном электроде (катоде). При пропускании через электроды аккумулятора зарядного тока в нем протекают обратные реакции. При перезаряде аккумулятора, после исчерпания сульфата свинца начинается электролиз воды, при этом на аноде выделяется кислород, а на катоде - водород.
Электрохимические реакции (слева направо - при разряде, справа налево - при заряде):
Реакции на аноде:
PbO2 + SO42- + 4H+ + 2e- ↔ PbSO4 + 2H2O;
Реакции на катоде:
Pb + SO42- - 2e- ↔ PbSO4.
Физические процессы, происходящие в аккумуляторе, объясняются свойством электролитического растворения металлов, которое заключается в переходе положительно заряженных ионов металла в раствор. Легкоокисляющиеся металлы (например, свинец) обладают этим свойством в большей степени, чем инертные металлы.
При погружении свинцового электрода в раствор электролита от него начнут отделяться положительно заряженные ионы свинца и переходить в раствор, при этом сам электрод будет заряжаться отрицательно.
По мере протекания процесса растет разность потенциалов раствора и электрода, и переход положительных ионов в раствор будет замедляться.
При какой-то определенной разности потенциалов электрода и раствора наступит равновесие между силой электролитической упругости растворения свинца, с одной стороны, и силами электростатического поля и осмотического давления - с другой.
В результате переход ионов свинца в электролит прекратится.
При погружении электрода, изготовленного из двуокиси свинца, в раствор серной кислоты наблюдается такой же процесс, но результат получается иной. Двуокись свинца в ограниченном количестве переходит в раствор, где при соединении с водой ионизируется на четырехвалентные ионы свинца Рв4+ и одновалентные ионы гидроксила ОН.
Четырехвалентные ионы свинца, осаждаясь на электроде, создают положительный потенциал относительно раствора. Серная кислота образует в воде практически только на ионы НO+ и HSO4.
Таким образом, при разряде аккумулятора расходуется серная кислота, образуется вода, а на обоих электродах - сульфат свинца. При заряде процессы протекают в обратном направлении.
При подключении потребителей в аккумуляторе возникает разрядный ток. При этом ионы сернокислотного остатка SO4 соединяются со свинцом электродов и образуют на них сернокислый свинец PbSO4, а ионы водорода соединяются с кислородом, выделяясь на положительной пластине в виде воды.
В результате электроды покрываются сернокислым свинцом, а серная кислота разбавляется водой, т. е. при разряде аккумулятора плотность электролита уменьшается. Поэтому по плотности электролита можно судить о степени заряженности аккумуляторной батареи.
При прохождении электрического (зарядного) тока через аккумуляторную батарею протекают обратные электрохимические процессы. Ионы водорода, образующиеся в результате распада воды, взаимодействуют с сернокислым свинцом электродов.
Водород, соединяясь с сернистым осадком, образует серную кислоту, а на электродах восстанавливается губчатый свинец. Выделяющийся из воды кислород, соединяется со свинцом положительной пластины, образуя перекись свинца.
В результате этих процессов содержание воды в электролите уменьшается, а содержание кислоты увеличивается, что приводит к повышению плотности электролита.
По завершению процессов восстановления свинца на электродах заряд аккумулятора прекращается. При дальнейшем прохождении электрического тока через электролит начинается процесс электролиза (разложения) воды, при этом аккумулятор «закипает», и выделяющиеся пузырьки образуют смесь водорода и кислорода. Смесь этих газов является взрывоопасной, поэтому следует избегать перезаряда до появления электролизных явлений по разложению воды.
Кроме того, длительный перезаряд приводит к потере электролитом воды (испарению), в результате чего его плотность повышается и для корректировки требуется доливка дистиллированной воды.
При доливке воды необходимо помнить, что вода, попадающая в концентрированную серную кислоту, закипает и сильно разбрызгивает кислотные капли, что при попадании на открытое тело или одежду может привести к ожогам кожи, слизистых оболочек, прожигу одежды и другим неприятным последствиям.
При постоянном напряжении источника зарядного тока по мере увеличения степени заряженности аккумулятора повышается его ЭДС и, следовательно, уменьшается сила зарядного тока. Когда напряжение на клеммах источника тока будет равно ЭДС полностью заряженного аккумулятора плюс ЭДС поляризации, зарядный ток прекратится.
Среднее значение напряжения аккумулятора – 2 В. Поскольку электрооборудование современных автомобилей рассчитано для работы при напряжении в бортовой сети 12 или 24 В, аккумуляторы соединяют в батареи (по 6 или 12 шт.).
Важным параметром аккумулятора является его емкость, т. е. количество электрической энергии, которую способен отдать аккумулятор. Емкость – это произведение силы разрядного тока на продолжительность разрядки до предельно допустимого разряженного состояния. Измеряется емкость аккумулятора в ампер-часах (А×ч). Емкость аккумулятора зависит, в первую очередь, от активной площади его электродов.
Поэтому повышения емкости можно достичь увеличением поверхности электродов, что достигается использованием нескольких параллельно соединенных между собой пластин, а также применением пористого материала для их изготовления, что позволяет использовать в качестве активной массы не только поверхность, но и внутренний объем пластин.
Емкость аккумулятора не постоянна, она зависит от силы разрядного тока, температуры электролита и состояния активной поверхности пластин. При увеличении разрядного тока и понижении температуры электролита емкость аккумулятора уменьшается, что объясняется неполным протеканием электрохимических реакций разрядки в этих условиях, вследствие сокращения времени разрядки и повышения вязкости электролита при низких температурах.
***
Устройство аккумуляторной батареи и ее маркировка
Главная страница
Дистанционное образование
Специальности
Учебные дисциплины
Олимпиады и тесты
Что такое АКБ? Устройство автомобильного аккумулятора

Аккумуляторная батарея (АКБ) – составной элемент электрооборудования транспортного средства. Автомобильная аккумуляторная батарея позволяет осуществить пуск двигателя, а также обеспечивает подачу электричества в бортовую сеть.
Единая цепь электрических аккумуляторов представляет собой аккумуляторную батарею. АКБ состоит из нескольких таких блоков аккумуляторов. Аккумулятор — химический источник электрического тока. Особенностью данного источника является его многоразовое действие, что позволяет активно эксплуатировать батарею для запусков ДВС.
Аккумулятор служит для накопления электрической энергии, выступая автономным источником электропитания. В основу действия аккумулятора положена обратимость химических процессов, которые происходят внутри него. Именно эта особенность позволяет использовать устройство многократно и циклически (постоянный заряд и разряд). Разряженный аккумулятор заряжают методом пропускания электрического тока в таком направлении, которое противоположно направлению тока при разряде аккумулятора. АКБ в процессе работы мотора заряжается от генератора прямо в подкапотном пространстве автомобиля.
Аккумуляторная батарея имеет корпус. В данном корпусе расположены перегородки, разделяющие батарею на ячейки (банки). Аккумулятор на 12 вольт, который чаще всего устанавливается на легковых автомобилях, включает в себя 6 ячеек. В каждой банке имеются небольшие блоки, которые соединены друг с другом.
В отдельном блоке имеются положительные и отрицательные электроды. Указанные электроды представляют собой пластины (решетки), которые изготовлены из свинца (на примере свинцового аккумулятора). Данные пластины покрыты особым активным составом. Между пластинами с положительными и отрицательными полюсами также находится разделитель (сепаратор). Сепараторы изготовлены из материалов, которые не пропускают электрический ток.
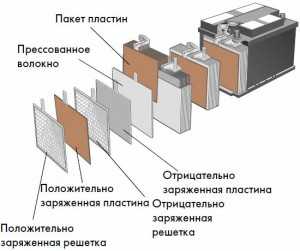 Внутрь банок аккумулятора на завершающей стадии изготовления батареи заливается электролит. Электролитом называется смесь серной кислоты и воды. Далее АКБ заряжается путем подключения батареи к специальному зарядному устройству. Подача тока на аккумулятор приводит к повышению плотности электролита. Химические реакции в ячейках аккумулятора заставляют батарею накапливать электрическую энергию.
Внутрь банок аккумулятора на завершающей стадии изготовления батареи заливается электролит. Электролитом называется смесь серной кислоты и воды. Далее АКБ заряжается путем подключения батареи к специальному зарядному устройству. Подача тока на аккумулятор приводит к повышению плотности электролита. Химические реакции в ячейках аккумулятора заставляют батарею накапливать электрическую энергию.
Автомобильный аккумулятор зачастую представляет собой свинцово-кислотную АКБ. Работает такая батарея на основе электрохимических реакций свинца и диоксида свинца, которые помещены в смесь серной кислоты и дистиллированной воды. Также встречаются гелевые, щелочные и гибридные автомобильные аккумуляторы, которые дополнительно делятся на обслуживаемые, малообслуживаемые и необслуживаемые.
Читайте также
VARTA® объясняет принцип действия системы Start-Stop в автомобилях. Убедитесь сами

Системы Start-Stop автоматически глушат двигатель и вновь запускают его для снижения времени работы на холостых оборотах, тем самым сокращая расход топлива и выбросы в атмосферу. Большая часть производителей устанавливают аккумуляторы VARTA® на новые автомобили с системами Start-Stop.
Аккумулятор - это сердце автомобиля. Он обеспечивает питание всего — от системы зажигания до постоянно работающих электрических систем транспортного средства и бортовых развлекательных систем. Аккумулятор обеспечивает постоянное питание всех остальных функциональных блоков, задействованных в процессе Start-Stop. Такие аккумуляторы делают гораздо больше, чем просто запускают двигатель. Именно поэтому АККУМУЛЯТОР — это СЕРДЦЕ автомобиля.
Сегодня большинство автомобилей снабжены системой Start-Stop, поэтому мы создали два инновационных аккумулятора VARTA®, поддерживающих ее: Аккумуляторы VARTA® Silver Dynamic с технологией AGM для автомобилей с усовершенствованной системой Start-Stop и рекуперативным торможением, и Blue Dynamic с EFB technology для традиционных систем Start-Stop.
Движение и разгон
Усовершенствованная система управления энергией выключает генератор при разгоне и в нормальном режиме движения автомобиля. За счет этого колеса получают больше мощности от двигателя. Генератор снова включается лишь тогда, когда заряд аккумулятора достигает установленного нижнего предела.
Требования к аккумулятору:
Аккумулятор разряжается и заряжается, при этом в одиночку обеспечивая питание всей электроники.
Торможение
Благодаря рекуперативному торможению кинетическая энергия автомобиля частично преобразовывается в электроэнергию, поступающую обратно в аккумулятор.
Требования к аккумулятору:
Аккумулятор должен быстро подзаряжаться и располагать достаточной емкостью для приема дополнительной энергии. Аккумулятор должен работать при низких уровнях заряда.
Остановка и выключение двигателя
Когда автомобиль останавливается, система Start-Stop глушит двигатель.
Требования к аккумулятору:
Аккумулятор должен даже в разряженном состоянии выдавать достаточно пусковой мощности для системы зажигания двигателя, чтобы снова запустить двигатель.
Электрический аккумулятор. Строение и принцип работы.
Электри́ческий аккумуля́тор — химический источник тока многоразового действия, основная специфика которого заключается в обратимости внутренних химических процессов, что обеспечивает его многократное циклическое использование (через заряд-разряд) для накопления энергии и автономного электропитания различных электротехнических устройств и оборудования.
Принцип действия аккумулятора основан на обратимости химической реакции. Работоспособность аккумулятора может быть восстановлена путём заряда, то есть пропусканием электрического тока в направлении, обратном направлению тока при разряде.
Несколько аккумуляторов, объединенных в одну электрическую цепь, составляют аккумуля́торную батаре́ю.
Для того чтобы ясно понять суть работы электрических аккумуляторов, давайте разберёмся с его устройством и общим принципом действия. И так — в основу работы всех химических источников электропитания заложены две составляющие: это пара электродов и электролит. Всё это находится в ёмкости, которая служит корпусом для электрического аккумулятора.
Электрический ток — это упорядоченное движение заряженных частиц (в твёрдых веществах, это электроны, а в жидких и газообразных, это ионы). Ток не может существовать без воздействия электродвижущей силы Э.Д.С. (разности потенциалов или напряжения). Значит, между электродами что-то должно создавать эту Э.Д.С. А создаёт её следующий процесс!
И так, у нас имеется сосуд с двумя электродами, погружённых в жидкий электролит. С точки зрения химии, в этом сосуде происходит растворение одного электрода (под действием кислотной или щелочной среды электролита) и восстановление (отложение слоя) другого. При этом от растворяющегося электрода (металла) отрываются ионы этого вещества, которые с собой уносят положительный заряд. А электроны, ранее принадлежащие этому атому металла и не имеющие возможности уйти с ним, остаются на этом электроде.
На другом же электроде будет происходить противоположный процесс, те ионы, которые были оторваны от первого, переходят на второй, неся в себе положительный заряд и постоянно прибавляя его к электроду. Весь этот химический процесс окислительно-восстановительной реакции сопровождается превращением одних веществ в другие, при заряде, и взаимообратный, при разряде электрического аккумулятора.
В итоге получается, что под воздействием внешнего источника электрического поля (в случае процесса заряда) мы принудительно превращаем одни вещества в другие, а при подключении к клеммам электрической нагрузки (создавая тем самым замкнутую цепь), мы позволяем накопленной электроэнергии выйти, по средствам обратного химического превращения веществ. Следует заметить, что электролит в этой электрохимической системе является переносчиком положительного заряда (ионов, оторванных от электрода), и они перемещаются внутри самого аккумулятора. А отрицательный заряд (то есть электроны) будет транспортироваться по внешней цепи, вне аккумулятора.
Принцип работы и устройство АКБ
Аккумуляторная батарея это ключевой элемент большинства устройств, агрегатов и механизмов. Устройство, такое как автомобильный аккумулятор, является весьма сложным по принципу действия. Предназначение, данное устройства это накапливание и отдача энергии различного рода потребителям.

Но главное предназначение аккумуляторной батареи это пуск двигателя, и уже после этого питание таких узлов как магнитола, печка, фары и т. д. Стоит знать, что энергия «аккумуляторной батарей» иногда дополняет недостаточную электроэнергию генератора. Чаще всего это происходит в пробках, где энергии генератора не хватает для питания всех включенных электроустройств.
Возможно, ездить на автомобиле с вышедшим из строя генератором, но далеко уехать не получится. Генератор это своего рода зарядное устройство, предназначенное непосредственно для аккумулятора. Сам же аккумулятор способен как отдавать энергию, так и принимать.
Из чего состоит и как работает
Сегодня представлено большое количество АКБ, где они отличаются друг от друга принципом работы и устройством конструкции. Особой популярностью пользуются батареи, в состав которых входит:
1. Свинец и кислота.
2. Кадмий и никель.
3. Цинк и серебро.
4. Щелочное железо и никель.
Самим распространенным видом является свинцово-кислотный АКБ, так как он самый дешевый и практичный вариант в этом плане. Остальные виды стоят дороже, и при этом нет гарантии, что они прослужат достаточно долго.
Работает аккумулятор по принципу преобразования одной энергии в другую. К примеру, когда происходит зарядка АКБ, электроэнергия преобразуется непосредственно в химическую. При разрядке аккумулятора преобразование энергии происходит в точности да наоборот. Принцип работы любой аккумуляторной батареи цикличен, так как в момент разрядки, диоксид свинца (положительные электроды) взаимодействуют с (отрицательными электродами), образуя химическую реакцию с жидкостью (электролитом).
В результате такой химической реакции образуется одновременно два вещества это сульфат свинца, и конечно же вода. Как факт при разрядке аккумулятора падает плотность электролита. Зарядить посаженную АКБ можно двумя способами — это использовать внешнее зарядное устройство, либо воспользоваться генератором. В процессе зарядки происходят следующие реакции, а именно в свинец превращается вода и сульфат свинца и в двуокись свинца преобразуется основанной элемент и серная кислота.
При завышенном показателе заряда АКБ увеличивается риск разложения электролита в результате батарея очень быстро выйдет из строя.
Вам будет интересно:
Как работает батарея? - интернет-магазин больно.com.pl
Глядя на аккумулятор, мы видим, что он имеет два полюса — один положительный, помечен «+», другой отрицательный — помечен «-». В случае типичных цилиндрических батарей, таких как R6/AA или R14/C (используемых, например, для питания фонариков или игрушек), полюса являются концами батарей. Тяжелые свинцовые зажимы используются в качестве полюсов автомобильных аккумуляторов.Электроны накапливаются на отрицательном конце батареи. Если мы соединим отрицательный полюс с положительным полюсом, электроны будут двигаться как можно быстрее от отрицательного полюса к положительному полюсу - батарея разрядится очень быстро (кроме того, мы не рекомендуем этот тип эксперимента из-за связанные с этим опасности - никогда не закорачивайте батарею таким образом "на короткое время"!).В нормальных условиях к аккумулятору кабелем подключается нагрузка — лампочка, двигатель или электронная схема, например радиоприемник.
Внутри батареи происходит реакция, в результате которой образуются свободные электроны. Скорость, с которой в результате этой реакции высвобождаются электроны (внутреннее сопротивление — сопротивление — батареи), очевидно, ограничивает число электронов, которые могут пройти между полюсами. Электроны должны течь от батареи через провод и нагрузку, от отрицательного полюса к положительному, чтобы произошла химическая реакция, которая освободит их еще больше.По этой причине мы можем оставить неиспользованную батарейку на полке, например, на год, а затем продолжать использовать ее без каких-либо проблем - пока электроны не перетекают от отрицательного полюса к положительному, химическая реакция не идет. происходит. В момент соединения полюсов начинается реакция.Химические реакции в батареях
Одной из самых простых батарей является углеродно-цинковая батарея. Глядя на реакции, происходящие внутри него, нам легче понять общий принцип работы всех аккумуляторов.Представьте, что у вас есть банка с серной кислотой (h3SO4). Если мы поместим в него цинковый стержень, то едкая кислота немедленно начнет его растворять. Мы увидим, как на поверхности цинка собираются пузырьки водорода, и стержень, и кислота начинают нагреваться.Вот что происходит:
- молекулы кислоты распадаются на три иона: два иона H+ и один SO4--
- атомов цинка на поверхности стержня теряют два электрона (2e-) и становятся ионами Zn++
- Ионы Zn++ соединяются с ионами SO4 - образуя ZnSO4, который растворяется в кислоте
- электронов от атомов цинка соединяются с ионами H+ и образуют молекулы h3 (газообразный водород)
- электроны начнут двигаться по проводу и соединиться с водородом на углеродном стержне, из которого теперь тоже начнут выходить пузырьки водорода
- значительно уменьшится тепловыделение; используя электричество, протекающее теперь через проводник, мы могли бы, например, запитать лампочку — и измерить результирующие напряжение и ток, протекающие через проводник — часть тепловой энергии была преобразована в движение электронов.
Известные нам батареи работают по тому же принципу. Они различаются типами используемых металлов и электролитов, но все они работают за счет одного и того же явления — перетекания электронов от одного полюса к другому.В зависимости от используемых компонентов меняется и характерное напряжение такой батареи. Давайте рассмотрим это на примере типичного свинцового автомобильного аккумулятора:
- батарея содержит одну пластину из свинца и другую пластину из диоксида свинца, обе погружены в электролит из высококонцентрированной серной кислоты
- свинец соединяется с SO4 с образованием PbSO4 и одного свободного электрона
- диоксида свинца, ионы водорода и ионы SO4, а также электроны со свинцовой пластины образуют PbSO4 и воду на пластине из диоксида свинца со временем обе пластины перекрываются PbSO4 и вода смешивается с кислотой; характеристическое напряжение составляет ок.2В - следовательно, соединив последовательно 6 ячеек, получим батарею ячеек с напряжением 12В
- цинко-угольные батареи – настолько популярны, что их иногда называют «обычными»; являются наиболее часто используемыми батареями таких размеров, как R6/AA, R14/C, R20/D; электроды здесь сделаны из цинка и
- углерода, между ними зажата кислотная паста, служащая электролитом
- щелочные батареи - их электроды изготовлены из оксида цинка и марганца, с щелочным электролитом литиевые батареи
- — в них используется литий, йодид лития или йодид свинца; их чаще всего используют в фотоаппаратах из-за того, что они способны давать энергию короткими, большими вспышками (необходимы для питания ламп-вспышек) Воздушно-цинковые батарейки
- — используются для питания слуховых аппаратов.
- аккумуляторы свинцово-кислотные - используются в автомобилях; электроды изготовлены из свинца и оксида свинца, в качестве электролита используется высококонцентрированная кислота
- никель-кадмиевые (Ni-Cd) батареи - электроды изготовлены из никеля и гидроксида кадмия, с гидроксидом калия в качестве электролита Никель-металлогидридные (Ni-MH) батареи
- - быстро заменили никель-кадмиевые батареи в большинстве приложений из-за отсутствия «эффекта памяти», присущего батареям Ni-Cd . Литий-ионные аккумуляторы
- — с отличным соотношением емкости и веса, чаще всего используются в ноутбуках и мобильных телефонах.
Соединение элемента/батареи
В предыдущем обсуждении мы использовали слова «батарея» и «ячейка» как синонимы. Это соответствует тенденции в повседневном языке. Однако с технической точки зрения слова «аккумулятор» и «ячейка» имеют совершенно разные значения. Таким образом, «ячейка» означает один источник питания, например, такой, как описанная выше банка для кислоты, и два стержня, соединенных проволокой (или, например, «палка» R6/AA). С другой стороны, «батарея» представляет собой набор взаимосвязанных ячеек (например,Батарея 3Р12, состоящая из трех элементов в одном корпусе, соединенных последовательно). Именно в этом смысле мы будем использовать эти два термина далее в этом тексте.Мы почти никогда не используем одну ячейку в большинстве устройств. Вместо этого мы подключаем несколько из них — либо последовательно для более высокого напряжения, либо параллельно для более высоких токов. При последовательном соединении получаем сумму напряжений соединенных ячеек; при параллельном соединении - сумма токов, полученных от составляющих ячеек.
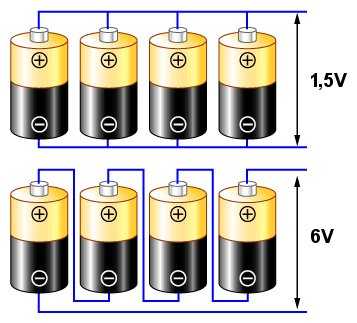
Соединение как на верхней схеме называется параллельным. Если мы предположим, что каждая ячейка имеет характеристическое напряжение 1,5 В (как типичный одиночный угольно-цинковый или щелочной элемент), напряжение, полученное на концевых выводах (указано стрелками), все равно будет 1,5 В, но полученный ток будет в четыре раза выше интенсивность, чем мы могли бы получить от одной клетки.
Соединение, показанное на схеме ниже, называется последовательным.В этом случае напряжения от отдельных ячеек суммируются, чтобы получить напряжение 6 В между клеммами.
При покупке батареи или элемента обычно можно прочитать на упаковке напряжение, а иногда и емкость. Например, типичные аккумуляторы, используемые в цифровых камерах, имеют напряжение 1,2 В и емкость 2000 мАч. Емкость 2000 мАч (мАч — сокращение от миллиампер-часы) означает, что теоретически такая батарея способна отдавать 2000 мА (2000 миллиампер или 2 ампера) в течение часа, ток 1А в течение двух часов, 100 мА в течение 20 часов. и т. д.Однако клетки обычно не ведут себя так линейно. Во-первых, каждая батарея имеет определенную максимальную силу тока, которую она способна обеспечить. Таким образом, батарея емкостью 500 мАч не сможет отдать 30 А за секунду, потому что химические реакции внутри батареи никак не могут дать столько электронов за такое короткое время. Во-вторых, при больших токах элементы обычно сильно нагреваются, на что уходит много их энергии. В-третьих, многие химические системы, используемые в батареях, работают меньше (или дольше!) с очень низким энергопотреблением.Тем не менее, емкость в ампер-часах дает хорошее представление о том, как долго прослужит данная ячейка при заданной потребляемой мощности в типичных условиях эксплуатации.
Copyright © Baltrade
.Как работает батарея? - Электрическая теория
Что такое электрод? Что такое ссылка? Из чего сделан аккумулятор? Как это работает? Какие бывают типы аккумуляторов? Что такое емкость батареи? Сколько энергии дает аккумулятор? Основные сведения о неперезаряжаемых гальванических элементах.
Электричество
Электричество — явление, тесно связанное с электрическими зарядами. О том, что они из себя представляют, я писал в статье о нагрузках. Благодаря подвижным нагрузкам можно передавать электроэнергию и снабжать ею различные устройства.Как заставить груз двигаться? Согласно всем теоретическим и экспериментальным знаниям, положительные и отрицательные заряды ощущают в своем присутствии естественную силу притяжения. Правда, в случае одиночных нагрузок эта сила пренебрежимо мала. Если бы, однако, удалось собрать и разделить большое количество таких зарядов, то результатом была бы необычно большая сила притяжения, способная смещать заряды и выделять значительную энергию.
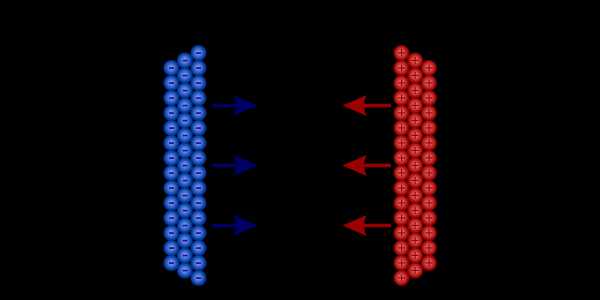 Накопившиеся заряды сильно притягиваются друг к другу - все благодаря разности потенциалов
Накопившиеся заряды сильно притягиваются друг к другу - все благодаря разности потенциалов Собрать большое количество зарядов и расположить их таким образом, чтобы они взаимодействовали с определенной силой - задача не из легких.Сам по себе он требует энергии (просто надо много работать в мире над ним). К счастью, мы можем восстановить любую заданную энергию позже. Его количество легко измерить, потому что там, где аккумулируется электричество, существует разность потенциалов . Эта разница, известная как электрическое напряжение , , отражает как собранную энергию, так и силу, с которой заряды «касаются друг друга». Подробнее об этом я писал в статье про разность потенциалов.
Отрицательные заряды притягиваются более высоким потенциалом, а положительные заряды притягиваются более низким потенциалом. Если бы мы сбросили все заряды сейчас (при достаточно высоком напряжении), это имело бы эффект, подобный удару молнии во время грозы. Это было бы зрелищно, но, к сожалению, недолго. Оба скопления зарядов будут лететь навстречу друг другу, сталкиваться друг с другом и тратить всю накопленную энергию за долю секунды.
Что, если вы попытаетесь контролировать этот процесс? Мы могли создать узкую щель, через которую могла пройти только часть зарядов.Мы бы не выпустили столько электричества сразу, но, дозируя его в небольших количествах, мы могли бы питать небольшое устройство таким образом в течение гораздо более длительного времени.
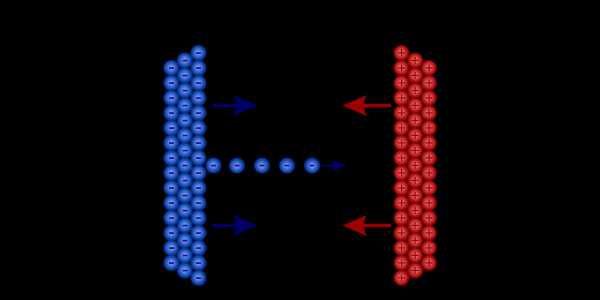 Ограничивая поток нагрузок, мы контролируем количество передаваемой энергии
Ограничивая поток нагрузок, мы контролируем количество передаваемой энергии Таким образом, производство и контролируемая передача электроэнергии связаны с двумя вещами:
- Получение большого количества зарядов и создание между ними разности потенциалов
- Дозирование накопленной энергии в нужное время благодаря контролю потока зарядов.
Как получить грузы и хранить их?
Давайте посмотрим, как мы можем решить вышеуказанные проблемы на практике. Основными заряженными частицами являются протоны и электроны. Протоны (положительный заряд) — относительно тяжелые молекулы, спрятанные внутри атомного ядра. До них добраться крайне сложно и нужно много сил, чтобы убедить их сделать то, что мы хотим. С другой стороны, электроны, вращающиеся вокруг этого ядра (отрицательный заряд), легкие, подвижные и часто довольно «слабо» привязаны к атому.Отрыв такого электрона от ядра в некоторых элементах не составляет ни малейшей проблемы и мы можем это сделать даже в домашних условиях. Низкая сила трения при расчесывании волос или трении куска меха о стекло заставляет электроны прыгать с одного предмета на другой. В результате один объект получает избыток электронов и становится отрицательно заряженным, а другой из-за недостатка электронов становится положительно заряженным.
 Атом, отняв электрон, становится катионом – положительно заряженной молекулой, в которой протонов больше, чем электронов.
Атом, отняв электрон, становится катионом – положительно заряженной молекулой, в которой протонов больше, чем электронов.Использование силы трения имеет два существенных недостатка. Во-первых, собранный таким образом заряд невелик, а во-вторых, эффект зарядки длится недолго. Подобно тому, как мы легко заряжаем предметы трением, воздух вокруг них, бомбардируя их своими частицами, использует ту же силу для разрядки накопленного нами заряда.
Есть еще несколько способов собрать больше грузов, которые мы обсудим чуть позже. К сожалению, хранение собранного груза — гораздо большая проблема.Физики еще не нашли удовлетворительного способа хранения электричества. Мы знаем, как хранить его с помощью конденсаторов, но этого количества никогда не будет достаточно по сравнению с потребностями электрических устройств. Единственный выход из этой ситуации — использовать другую форму энергии, которую гораздо проще хранить, а затем преобразовывать в электричество.
Химическая энергия
Если у нас нет идеи решения проблемы, лучше посмотреть, как с ней справилась природа.Наиболее распространенным видом запасенной энергии в природе является химическая энергия. Прекрасным примером здесь является сырье, такое как уголь и древесина. Благодаря реакции горения мы можем преобразовывать химическую энергию, хранящуюся в сырье, в свет и тепло. В свою очередь, химическая энергия пищи питает наши тела, а химическая энергия бензина питает наши автомобили. Возможно, химическая энергия также будет питать наши телефоны и часы? Шанс для этого есть, благодаря т.н. реакция окисления и восстановления также называется окислительно-восстановительной реакцией.
Окисление и восстановление
Для питания электрических устройств требуется поток зарядов. Окислительно-восстановительный потенциал — это тип химической реакции, которая делает этот поток возможным. В нем происходят в основном два явления:
- Атомы первого элемента окисляются , поэтому отдают свои электроны
- Атомы второго элемента легко принимают электроны и таким образом восстанавливаются
Объединение материалов с дефицитом электронов и материалов с их избытком выглядит отличным способом обеспечения стабильного потока заряда.Естественно, не все элементы одинаково легко окисляются или восстанавливаются. Безусловно, чаще всего используются металлы (такие как литий, цинк, медь, свинец) и их соединения. Металлы настолько дружественны к окислительно-восстановительной реакции, что могут подвергаться ей даже в естественных условиях, что широко известно как явление -коррозия .
Электролит
Разумеется, самопроизвольная коррозия металла исключена. Чтобы получить электричество, нам нужно контролировать весь процесс переноса электрона.Это делается путем погружения металла в специальный раствор, называемый электролитом . Это может быть соль, кислота или любое другое соединение, которое при растворении (например, в воде) распадается на положительных и отрицательных ионов. Отрицательные ионы – это атомы, имеющие избыточное количество электронов (анионы), а положительные атомы страдают от недостатка (катионы). Об этом я уже писал в статье об электрических зарядах. Химики также обнаружили, что металлы чаще всего реагируют с электролитами, которые уже содержат свои собственные ионы.Например, цинк очень легко окисляется в электролите, который уже содержит катионы цинка. Давайте посмотрим, что на самом деле происходит с металлом, погруженным в электролит, на двух примерах:
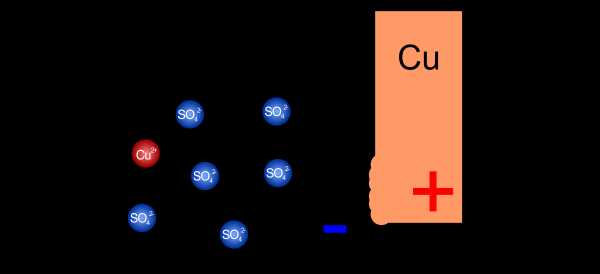
Окисление цинка
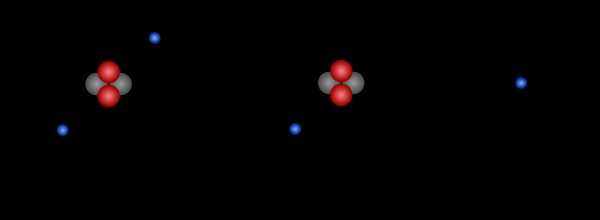
Если электролит, называемый сульфатом цинка, растворить в воде, он распадается на положительные ионы цинка и отрицательные сульфат-ионы. Когда мы поместим в такой раствор цинковую пластину, она начнет окисляться, или, образно говоря, растворит .Атомы цинка будут пытаться превратиться в положительные ионы, чтобы присоединиться к другим ионам цинка в растворе. Преобразование атома в ион стоит денег — атом цинка должен оставить после себя два электрона.
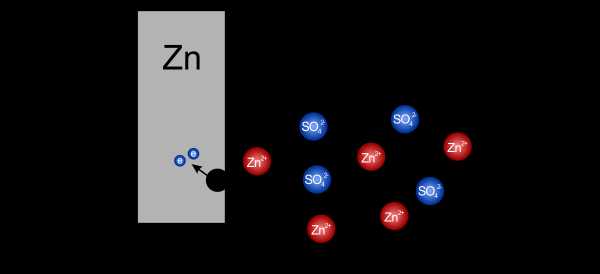 Атомы цинка растворяются в электролите, теряя два электрона
Атомы цинка растворяются в электролите, теряя два электрона Оставление электронов на пластине и уход положительного иона в раствор вызывает дисбаланс заряда. На пластине начинает накапливаться отрицательный заряд, а в растворе оказывается все больше и больше положительных ионов.Эта ситуация постепенно препятствует проникновению в раствор дальнейших ионов. Концентрация положительных зарядов настолько велика, что последующие атомы не могут проникнуть через нее. Через какое-то время установится равновесие, и пока мы как-то не разрядим накопившиеся заряды, дальнейшее окисление будет невозможно.
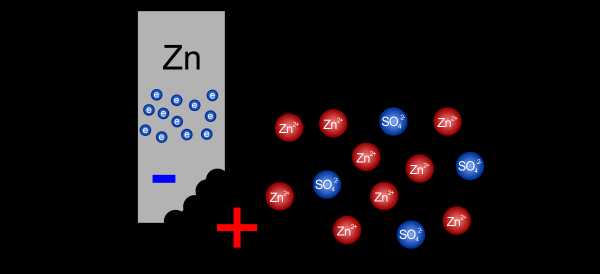 Накопление электронов на пластине и катионов в растворе останавливает дальнейшее окисление
Накопление электронов на пластине и катионов в растворе останавливает дальнейшее окисление Пластина, на которой мы таким образом собрали отрицательный заряд, называется отрицательным электродом (анодом), а электрод, погруженный в электролит, создает наполовину -сотовый
Медный редуктор
При растворении сульфата меди в воде получается раствор, наполненный положительными ионами меди () и отрицательными ионами сульфата ().Помещая медную пластину в такой раствор, мы вызываем массовое выделение меди из раствора, технически известное как восстановление . Ионы меди начнут оседать на пластине, используя все свободные электроны на ней.
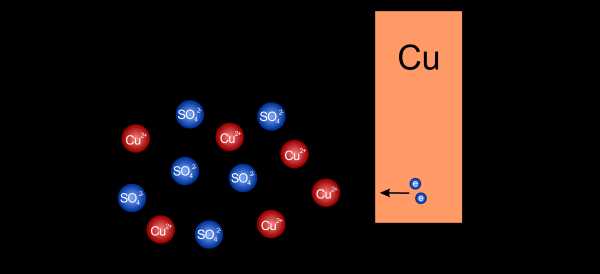 Катионы меди оседают на пластине, забирая имеющиеся электроны
Катионы меди оседают на пластине, забирая имеющиеся электроны На пластине начнет увеличиваться положительный заряд, а в растворе отрицательный. Положительным ионам меди будет все труднее и труднее приближаться к пластине, и реакция со временем остановится. Если мы каким-то образом не сбалансируем нагрузки, дальнейшее снижение будет невозможно.
 Отсутствие свободных электронов на пластине и накопление анионов в растворе препятствуют дальнейшему восстановлению
Отсутствие свободных электронов на пластине и накопление анионов в растворе препятствуют дальнейшему восстановлению Пластина, на которой мы таким образом собрали положительный заряд, называется положительным электродом (катодом), а электрод, погруженный в электролит создает полуэлементов
Гальванический элемент
Сопоставив два таких полуэлемента рядом, мы создаем гальванический элемент , также известный как гальванический элемент (в честь двух соперничающих ученых).Как упоминалось ранее, реакции окисления и восстановления в какой-то момент останавливаются, устанавливая потенциал каждого электрода (один отрицательный, а другой положительный). Таким образом, между электродами возникает разность потенциалов .
 Существует разность потенциалов между электродами ячейки
Существует разность потенциалов между электродами ячейки Используя химическую энергию, мы смогли генерировать электрическое напряжение. Создав правильный путь между двумя потенциалами, мы вызовем поток зарядов между ними:
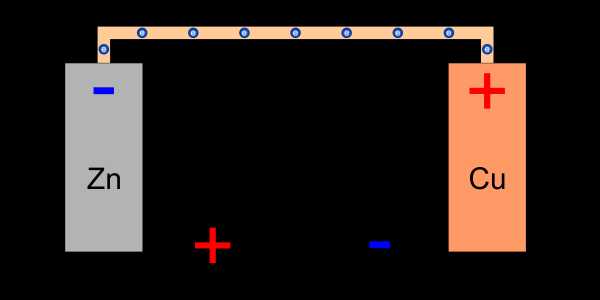 Соединение электродов позволяет стекать зарядам, накопленным на аноде
Соединение электродов позволяет стекать зарядам, накопленным на аноде Благодаря соединению электродов анод избавляется от избыточных электронов, препятствующих окислению, а к медной пластине поступают новые электроны, что позволяет уменьшить далее катионы меди.По идее, окислительно-восстановительная реакция должна начаться снова, но через некоторое время возникнет другая проблема, о которой я раньше не упоминал. Поток электронов разряжает потенциал пластины, но создаваемый в электролите потенциал все же затрудняет и в итоге останавливает дальнейшую окислительно-восстановительную реакцию.
Ионная проводимость
Потенциал, созданный в электролитах, блокирует дальнейшее проникновение цинка и утечку меди. Чтобы окислительно-восстановительная реакция продолжалась, полученный заряд должен быть несколько уравновешен, и есть три основных способа сделать это.
Оба резервуара для электролита можно комбинировать с т.н. с электролитическим ключом . Он наполнен ионами, которые проникают в оба электролита, восстанавливая баланс заряда. Одним из примеров может быть водный раствор соли. Содержащиеся в нем анионы хлора будут притягиваться к электролиту, где будет возрастать положительный потенциал. С другой стороны, катионы натрия будут проникать в электролит с отрицательным потенциалом.
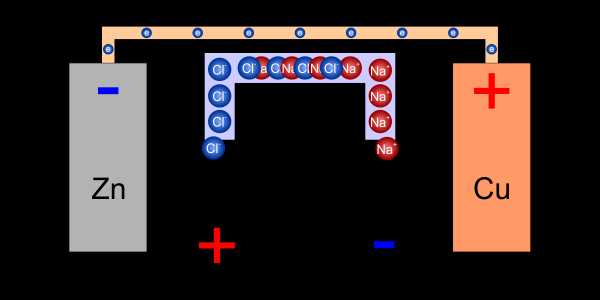 Электролитический ключ обеспечивает ионы, необходимые для балансировки зарядов в электролитах
Электролитический ключ обеспечивает ионы, необходимые для балансировки зарядов в электролитах Если оба электролита имеют общее свойство, такое как наличие отрицательных ионов сульфата, их можно соединить специальным барьером, который пропускает поток сульфата, но блокирует цинк и медь .
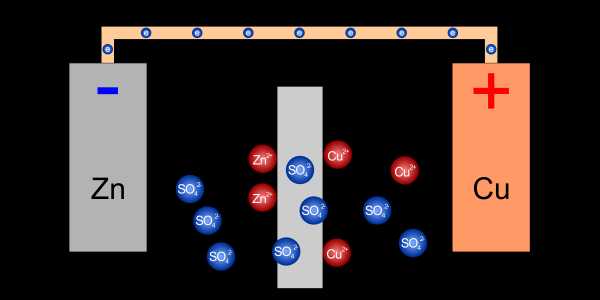 Подходящий барьер позволяет проходить сульфат-ионам, блокируя катионы цинка и меди
Подходящий барьер позволяет проходить сульфат-ионам, блокируя катионы цинка и меди Может быть, мы могли бы пойти дальше и выбрать электроды для окислительно-восстановительного потенциала в одном, общем электролите ? Тогда не было бы необходимости в барьере, и ионы могли бы течь свободно, если это необходимо.
 Благодаря соответствующему подбору электродов можно использовать общий электролит
Благодаря соответствующему подбору электродов можно использовать общий электролит Поток ионов в электролите необходим для дальнейшего протекания окислительно-восстановительной реакции, и какой из вышеперечисленных методов мы выберем, зависит от типа клетка, как она сделана и ее назначение.
Напряжение ячейки
Теперь, когда мы решили проблему потоков электронов и ионов и создали в основном автономную окислительно-восстановительную реакцию, пришло время перейти к точным числам. Если напряжение напрямую переводится в доступную энергию, то давайте проверим, какую разность потенциалов мы можем получить от такой ячейки.
Электроды изготавливаются из различных материалов и химических соединений. Чтобы определить потенциал электрода, начните с проверки его нормального потенциала.В случае металлических электродов мы можем прочитать это из ряда напряжений металлов :

Нормальный потенциал – это потенциал, который будет создаваться на электроде при его погружении в электролит. Стоит помнить, что металлы с низким потенциалом очень хорошо окисляются, тогда как металлы с высоким потенциалом легко восстанавливаются.
Благодаря таблице мы знаем относительный потенциал, который возникнет на данном электроде при протекании реакции окисления и восстановления.Для расчета напряжения между двумя электродами сложите значения нормальных потенциалов без знаков минус . В нашем примере с цинковым и медным электродом получаем:
(1)
Не так много, верно? Элементы, вступающие в окислительно-восстановительные реакции, к сожалению, имеют свои пределы. Их достаточно для производства часовых батареек на 1,5 В или популярных «палочек», но невозможно изготовить одну ячейку на 9 В или 12 В. Как получается это напряжение?
Аккумулятор
Слово батарея стало настолько популярным, что допустимо так обозначать отдельные гальванические элементы.Однако для правильного определения батареи требуется несколько соединенных друг с другом ячеек (чаще всего последовательно , т.е. одна за другой).
Соединяя ячейки последовательно, мы складываем их напряжения.Соединение ячеек позволяет значительно увеличить доступное напряжение. Общее напряжение равно сумме напряжений каждой ячейки. В приведенном выше случае:
(2)
Если более высокое напряжение означает больше энергии, почему до сих пор производятся аккумуляторы на 1,5 В или 3 В? Обратите внимание, что соединение нескольких ячеек значительно влияет на вес и размер батареи .Иногда разница в напряжении в один-два вольта не стоит удвоения веса батареи. Иногда лучше ограничить энергетические потребности устройства и заставить его работать на более низком напряжении, а вместо этого сосредоточиться на сроке службы элементов.
Какова емкость аккумулятора?
Напряжение ячейки — не единственная часть головоломки. Одной из самых больших проблем с современными аккумуляторами является их емкость. На сколько хватит батареи и что влияет на время ее работы?
Энергия батареи поступает в наши устройства с помощью электронов.Приобретение этих электронов на цинковом электроде возможно благодаря растворению металла в растворе . Если металл полностью растворится, запас электронов закончится. Поэтому нас интересуют два выпуска:
- Сколько тока мы потребляем (сколько зарядов в секунду течет по цепи)?
- Как долго мы сможем потреблять такой большой ток (сколько часов работы пройдет, прежде чем мы израсходуем все заряды и аккумулятор разрядится?)
Вышеуказанные факторы описываются так называемой емкостью аккумулятора , выраженной в ампер-часах (Ач).Если образец аккумулятора имеет емкость 1 Ач, то мы сможем вытянуть из него 3600 кул заряда, согласно следующему расчету:
(3)
Как долго нам хватит этого заряда? Это зависит от того, какой ток мы будем потреблять (сколько зарядов в секунду нужно питаемому устройству). Если батарея имеет емкость 1 Ач и устройство потребляет ток 0,5 А, оно будет работать в течение 2 часов. При токе потребления 0,1 А хватает на 10 часов.
Количество зарядов в батарее зависит от структуры батареи. Чем больше электроды, тем больше электронов они смогут отдать/получить и тем больше времени потребуется, чтобы их «носить». Чтобы не ставить аккумуляторы размером со стержни в наши телефоны, производители пошли другим путем. Используя материалы с более плотной структурой для создания электродов (больше атомов, упакованных в одно и то же пространство), мы увеличиваем количество электронов, не влияя на размер самой батареи. Значение количества ампер-часов, которое мы можем извлечь из каждого грамма материала, называется электрохимическим эквивалентом. Вес аккумулятора так же важен, как и его размер, поэтому в приведенной ниже таблице показано эквивалентное значение также в пересчете на объем. В таблице представлены данные для различных материалов, фактически используемых для изготовления анодов и катодов:

Емкости батареи, указанной производителем, к сожалению, нельзя доверять. Они выражают возможности своих продуктов на основе различных критериев, принятых ими при тестировании элементов. Кроме того, такие устройства, как смартфоны, потребляют разный ток в зависимости от использования и рабочей температуры, поэтому теоретическое время автономной работы может значительно отличаться от реального.
Сколько энергии имеют производимые аккумуляторы?
Емкость батареи— чрезвычайно полезная величина, но не следует забывать о вышеупомянутых нескольких подразделах раннего напряжения ячейки (разность потенциалов между электродами). Зная напряжение и емкость батареи, мы можем рассчитать теоретическую энергию элемента , выраженную в ватт-часах (Втч):
(4)
Аккумулятор емкостью 20 Ач и напряжением 3 В (энергия равна 60 Втч) сможет передавать в два раза больше энергии, чем аккумулятор емкостью 20 Ач, 1,5 В (энергия равна 30 Втч).Теоретически отправляются те же электроны и такое же количество кулонов, но более высокое напряжение увеличивает количество доставляемой энергии.
Напряжение при питании электроприборов может выражаться во многом. Проще говоря, он отвечает за силу, с которой аккумулятор способен «продавливать» электроны по цепи. Чем большее сопротивление наше устройство оказывает электронам, тем больше силы и энергии требуется для поддержания надлежащего потока зарядов.
Отличным примером является работа стандартной аккумуляторной отвертки.Аккумуляторы для шуруповертов разных производителей могут иметь напряжение 10 В, 12 В или 24 В. Более высокое напряжение аккумулятора не означает, что мы сможем дольше работать на одном заряде (это зависит от емкости), Более высокое напряжение позволяет производителю для увеличения оборотов двигателя или общего улучшения доступной мощности.
Проблема производительности батареи гораздо сложнее, чем я смог представить в этой статье. Стоит знать, что современные аккумуляторы прошли чрезвычайно долгий технологический путь.Мы научились заменять жидкие электролиты пастой и сухим порошком, мы открыли соединения металлов, которые позволяют восстанавливать и окислять с беспрецедентной эффективностью, а сами батареи становятся меньше и способны питать все более и более совершенные устройства. В конце статьи хотелось бы сравнить самые популярные типы аккумуляторов между собой по напряжению, емкости и энергии. Рекомендую обратить внимание на разницу между теоретическими и реальными значениями. Расхождения действительно велики, что показывает, как много факторов влияет на фактическую работу гальванических элементов.

Последнее слово ...
В данной статье представлен общий принцип работы первичных элементов (неперезаряжаемых батарей) и их наиболее важные особенности. Использование, преимущества и недостатки, а также конструкцию отдельных типов аккумуляторов вы найдете в другой статье. Если вам интересно, где кислотные, никелевые и литий-ионные батареи, позвольте мне объяснить. Ну, они относятся к группе батарей (так называемые вторичные или перезаряжаемые элементы). И хотя я много раз упоминал аккумуляторы в этой статье, для них также предусмотрена отдельная статья.
Библиография
- Справочник Linden по батареям - T. Reddy, McGraw-Hill, четвертое издание,
- Серия напряжений металлов, гальванических элементов - К. Москва, Б. Мазуркевич, Интернет-ресурсы АГХ Университета,
- Литиевые батареи и другие электрохимические системы хранения - C. Glaize, S. Genies, ISTE Ltd, Великобритания,
Тебе понравилось это? Взгляни на
и поддержите мою дальнейшую работу!

Или, может быть, вы хотели бы прочитать интересную книгу?
Уведомлять вас о новых статьях?
Я рекомендую подписаться на рассылку новостей или посетить Facebook.Таким образом, вы не пропустите ни одного нового текста!Я отправил вам электронное письмо!
Пожалуйста, проверьте свой почтовый ящик и подтвердите, что хотите подписаться на информационный бюллетень.
.
Собери батарейки! -
| Использованные батареи следует собирать и утилизировать отдельно. процессы восстановления и переработки! |
| После разрядки первичных батарей и потери емкости перезаряжаемыми батареями, пожалуйста, см. специальный контейнер для использованных батареек! |
Чтобы получить электричество, мы должны создать поток электронов. Для этого мы помещаем разделитель между двумя элементами.
Если мы теперь возьмем цинк и диоксид марганца извне, поместив между ними какое-либо электрическое устройство, генерируемый поток электронов заставит его питаться электронами.
Поток электронного заряда приводит к возникновению электрического тока. Электроны возвращаются в аккумулятор через положительный электрод (MnO2), они реагируют «восстановительно» с активным материалом, что приводит к протеканию тока через сепаратор к отрицательному электроду в виде ионов. Окислительные реакции, происходящие на отрицательном электроде между активным веществом и ионами, в результате генерируют избыток электронов, которые можно «выпустить» во внешнюю циркуляцию.Чтобы «успокоить» поток ионов, добавьте в аккумулятор электролит.
Существенным фактом является то, что система закрыта. На каждый электрон, «произведенный» в процессе анодного окисления, приходится один «использованный» электрон в процессе восстановления на катоде.
В результате происходящего процесса активное вещество «убивает», реакции начинают протекать все медленнее и медленнее, пока батарея не перестает «производить» электроны. В этот момент батарея разряжена.
Батареи всегда «производят» постоянный ток (электроны движутся в одном направлении), в отличие от энергосистемы, которая снабжает нас переменным током.Это означает, что при использовании батарей мы должны обращать внимание на их полярность.
Первичные батареи
Первичные батареи — это батареи, которые рассчитаны на полную разрядку только один раз. Часто первичные батареи состоят из материалов, используемых при производстве вторичных батарей. Однако их конструкция и производственный процесс совершенно разные. Поэтому не перезаряжайте первичные батареи!!!
Среди типов первичных батарей преобладают:
- Батарейки Al-Mn (щелочной марганец)
- Батареи Zn-Cb (цинково-угольные)
- Батареи Zn-O2 (воздушно-цинковые)
- Li (литиевые) батареи
- AgO (серебро) батареи
- Батарейки HgO (ртуть)
Возобновляемые батареи (вторичные, перезаряжаемые батареи)
Возобновляемые батареи работают так же, как первичные батареи, с той разницей, что химические процессы, происходящие в них, могут быть переворачивается загрузочным механизмом.В результате этого действия аккумулятор «восстанавливает» свои первоначальные текущие свойства. В зависимости из используемых композитов такие батареи имеют срок службы от 100 и 1000 циклов.
Типовые аккумуляторы:
- Ni-Cd (никель-кадмиевые) батареи,
- Ni-MH (никель-металлогидридные) батареи,
- Батареи Pb (свинцово-кислотные),
- Li-ion (литий-ионные) аккумуляторы,
- Аккумуляторы Al-Mn (щелочные марганцевые).
Особенностью возобновляемых батарей является освобождение его емкость за меньшее время, чем у батареи первичный смысл в том, что он управляется дистанционно машина поедет быстрее и лампа поедет быстрее вспышка на камере будет заряжаться короче.
В низковольтных устройствах аккумуляторы щелочной должен работать от 3 до 4 раз больше, чем перезаряжаемые батареи. Поэтому важен правильный тип товара аккумулятор для приемника.
Производимые батареи имеют следующие формы:
цилиндрический, блочный и кнопочный и маркировка размеров ААА, АА, А, С, D, G
Условия хранения
Важным является срок службы батареи, означающий их возможность сохранить оригинал емкость и другие параметры по тому, как долгое время.Для первичных батарей это так:
90 104 90 038 щелочной = 7 лет Но с батареями возобновляемые должны быть возвращены комментарии:
не следует хранить безадресное время души (свыше 1 год) в противном случае их свойства ухудшилось.
| , кроме каждого разряда перед перезарядкой, никакой другой обработки не требуется. |
| не требуют никакой обработки, хотя при перезарядке тоже должны разряжаться (не так часто, как Ni-Cd). Неиспользованные заряженные аккумуляторы этих типов разряжаются через 8–12 недель. |
| нельзя хранить заряженным более 6 месяцев. В противном случае батарея может быть полностью повреждена. |
последовательные и параллельные соединения
, соединяя аккумуляторы в соответствующие серии, мы можем получить либо более высокое напряжение (последовательное соединение), либо большую емкость (параллельное соединение). Типичным примером является батарея на 9 Вольт...
Для подключения используйте батареи того же типа. Потому что самая слабая батарея определяет мощность целой серии батарей.
www.vimtech.net .Аккумуляторная батарея, батарея, топливный элемент -
принцип работыЭлектрическая батарея представляет собой вторичный гальванический элемент, который, в отличие от первичных элементов, можно многократно перезаряжать и использовать. Аккумуляторы имеют два режима работы:
- работа , при которой она является источником электроэнергии, вырабатываемой в результате химических реакций (приводит к разрядке батареи)
- зарядка , при которой берет электроэнергию извне для преобразования его в химическую энергию и регенерацию субстрата.
Основным параметром, описывающим батареи, является емкость, которая определяется как способность ячейки сохранять электрический заряд. Емкость выражается в ампер-часах [Ач]. 1 Ач означает, что батарея может отдавать 1 А в течение 1 часа.
Способность заряжать аккумуляторы обусловлена обратимым характером протекающих в нем реакций. К сожалению, кроме основных реакций в батареях существуют и побочные реакции, расходующие необходимые субстраты и приводящие к потере работоспособности устройства.
Наиболее популярной электрической батареей является свинцово-кислотная батарея . Он состоит из ряда гальванических элементов, состоящих из:
- анод из металлического свинца,
- катод из оксида свинца (IV),
- электролит, представляющий собой 40% водный раствор серной кислоты (VI) .
В ячейке происходят следующие реакции:
По ПКО - Работа собственная, CC BY-SA 4.0, https://commons.wikimedia.org/w/index.php?curid=56178163
Батареи есть все более популярными становятся литий-ионные.Батареи используются в автомобилях с двигателем внутреннего сгорания и электромобилях или в системах аварийного питания.
Аккумулятор представляет собой первичный гальванический элемент, т.е. такой, который нельзя перезарядить - он одноразовый. Самыми популярными являются щелочные батареи , в которых используется электролит с щелочным (щелочным) pH. Как и в батареях, электрическая рекка возникает в результате преобразованной химической реакции. Аккумуляторы изготовлены из:
- цинкового порошка анода,
- порошка оксида марганца (IV) катода,
- электролита гидроксида калия.
Схема строения батареи следующая:
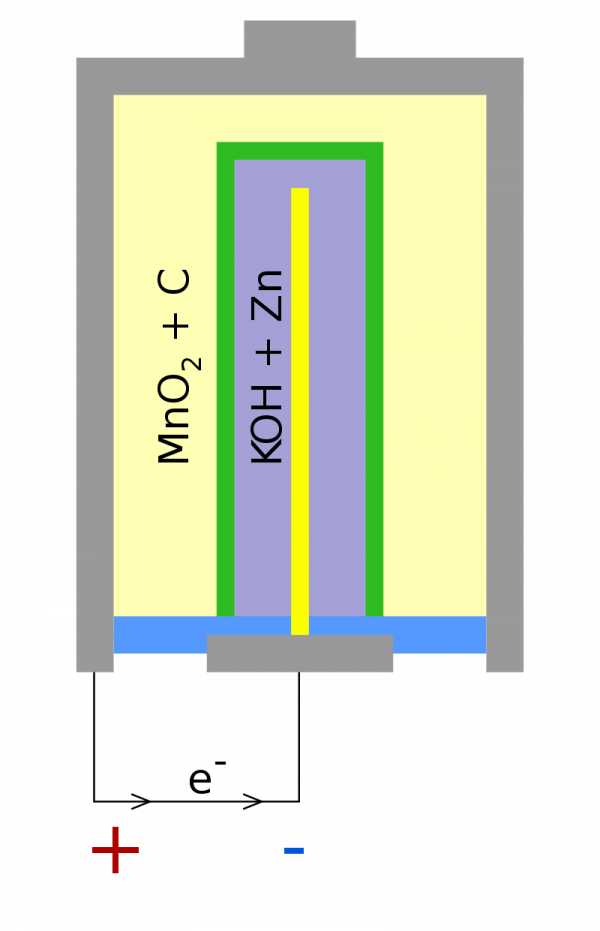
На электродах батареи протекают реакции:
катод: 2MnO 2 + H 2 O + 205 M 20 4 0 5 90 4 0 5 90 - - - - - O 3 + 2OH -
анод: Zn + 2OH - → Zn (OH) 2 + 2e -
элемент, вырабатывающий электричество за счет реакций окисления извне.В отличие от рассмотренных выше аккумулятора и батареи, электроэнергия в топливном элементе не накапливается, а вырабатывается на постоянной основе. Топливные элементы не нужно заряжать. Наиболее популярными топливными элементами являются водородно-кислородные элементы. Их строение показано на схеме ниже:
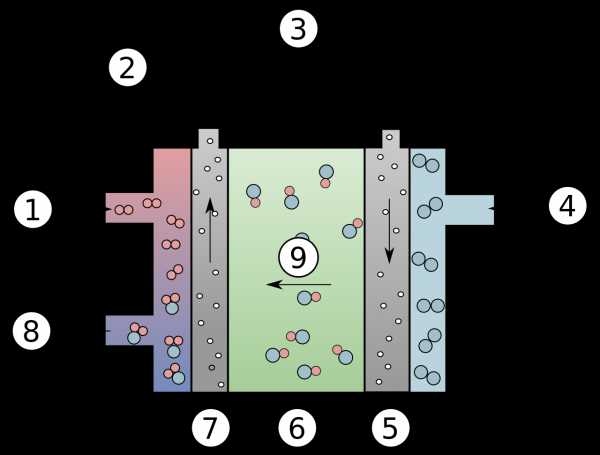
Структура щелочного топливного элемента: 1 - водород, 2 - поток электронов, 3 - зарядка (приемник энергии), 4 - кислород, 5 - катод, 6 - электролит, 7 — анод, 8 — вода, 9 — гидроксильные ионы
Создано Darryl Ring, Векторизация: Chabacano — Изображение: Alkalinecell.png, CC BY-SA 3.0, https://commons.wikimedia.org/w/index.php?curid=1645856
В рассматриваемой ячейке происходят следующие реакции:
анод: 2H 2 → 4H + + 4E -
Катод: O 2 + 4E - → 2O 2 -
только протоны диффундируют через полупрофильное мембран (H + ).
Топливные элементы используются в мобильных роботах, космических кораблях, системах аварийного питания, сотовых телефонах и подводных лодках.
.Батареи и аккумуляторы - Профессиональный электрик
Сегодня сложно представить работу многих бытовых устройств без батареек или аккумуляторов. Будильники, электробритвы, зубные щетки, электромобили, игрушки, автомобили и мобильные телефоны — это лишь несколько примеров использования батареек или аккумуляторов, относящихся к химическим источникам энергии. Энергия химических связей содержащихся в них веществ превращается в электричество в результате протекающих химических реакций.
Фото 1. Популярные батарейки типа АА разных производителей. Фото: www.shtr.eu Химическое действие источника питания основано на сочетании активных веществ и электролита. В батареях и аккумуляторах этот комплект работает как элемент, содержащий положительный и отрицательный электроды и электролит в индивидуальном закрытом корпусе. Элементами могут быть первичные элементы (к которым относятся батареи), характеризующиеся выработкой ими электроэнергии в результате необратимой химической реакции и не подзаряжаемые другими источниками электроэнергии.Вторая вариация — вторичные элементы, в которых выработка электричества происходит в результате обратимой химической реакции и может заряжаться от других источников электричества. Батареи относятся к этой группе элементов.
Батареи и аккумуляторы могут иметь различную форму и размеры. Электрическая единица, описывающая батареи, по которой они различаются, представляет собой электрическое напряжение батарей. В случае аккумуляторов часто эта единица дополнительно представляет собой емкость аккумулятора, указанную в ампер-часах (Ач).Серия стандартов из серии PN-EN60086 посвящена батареям и аккумуляторам. Каждая батарея или аккумулятор маркируется соответствующей маркировкой, благодаря которой производителям электрооборудования с питанием от батарей или аккумуляторов легко указать пользователю, какой источник следует приобрести для данного устройства. Первая буква в обозначении аккумулятора говорит о технологии, по которой он был изготовлен. Второй определяет свою форму как в списке ниже:
- первая буква - технология изготовления: (нет) - цинк-угольный (графитовый) элемент
- вторая буква - форма ссылки
A - цинково-воздушный элемент
B - литий-углеродный элемент
C - литий-марганцевый элемент
E - литий-тиониловый элемент
F - литий-железный элемент
H - перезаряжаемый никель-металлогидридный элемент (NiMH батарея)
K - (общее обозначение) перезаряжаемый никель-кадмиевый элемент (Ni-Cd аккумулятор)
L - щелочной элемент Браунштейна (анод: цинк; электролит: гидроксид щелочного металла; катод: оксид марганца IV)
M - ранее: ртутный элемент; в настоящее время: литиевая перезаряжаемая батарея
P - щелочно-воздушная батарея
S - серебряная батарея
Z - никель-марганцевая (Ni-Mn) батарея
R - цилиндрическое звено
F - пластинчатое звено
S - прямоугольное звено
Разнообразие аккумуляторов обусловлено различными конструкциями и материалами, используемыми при их производстве. Это, в свою очередь, приводит к тому, что разные типы аккумуляторов различаются по электрическим параметрам. Ниже представлены основные типы аккумуляторов.
- Цинк-угольные аккумуляторы - имеют номинальное напряжение элемента 1,5 В. Это самый старый тип аккумуляторов, представленный в широкой продаже. Эти батареи также часто называют цинк-графитовыми батареями.Применяются для питания устройств с малым током (до 100 мА). Они характеризуются низкой себестоимостью производства и невысокой ценой. Батареи этого типа нельзя оставлять в устройстве, если они разряжены. Очень часто из них вытекает электролит, что может привести к повреждению оборудования. Вы можете найти их в фонариках, игрушках, калькуляторах, часах и т. д.
- Щелочные батареи - с напряжением элемента 1,5 В. Эти типы батарей хорошо работают в устройствах со средним (100-300 мА) и высоким энергопотреблением (0,5 С; численно ток емкостью 1000 мАч равен называется током нагрузки 500 мА).Они отличаются большей емкостью, более длительным сроком службы и более широким диапазоном рабочих температур (-30°С...+70°С) по отношению к угольно-цинковым аккумуляторам. Срок хранения щелочных батарей составляет примерно 5-7 лет и больше, чем у угольно-цинковых батарей, где срок хранения составляет максимум 2 года. Разливы электролита (при полной разрядке) случаются гораздо реже. Щелочные батареи определенно дороже, чем их угольно-цинковые аналоги.
- Воздушно-цинковые батареи - в основном характеризуются очень длительным сроком хранения, который практически не ограничен до тех пор, пока они не подвергаются воздействию воздуха. После «активации» время работы данного типа аккумуляторов не очень велико и составляет 3-4 месяца. Они используются в слуховых аппаратах и устройствах телеметрии.
- Батареи литий-марганцевые - это батареи с номинальным напряжением элемента 3 В.Их основной особенностью является высокая устойчивость к температурным колебаниям и очень высокая плотность энергии. Это позволяет получить в три раза больше энергии от батареи размера AA, чем от щелочной батареи того же размера. Литиевые аккумуляторы широко используются в устройствах, требующих надежности. Они могут работать в диапазоне температур -40°С...+65°С и отличаются низкой скоростью саморазряда, благодаря чему срок их хранения достигает до 10 лет.
- Батареи литиевые (Li-FeS2) - были представлены на потребительском рынке в 2007 году.от Энерджайзер. Их номинальное напряжение составляет 1,7 В, и они отличаются устойчивостью к перепадам температуры и очень долгим сроком службы — даже до 15 лет. Литиевые батареи очень устойчивы к разряду большим током, например, в лампах фотовспышек. При нагрузке высоким разрядным током литиевые батареи имеют в 4 раза большую емкость, чем щелочные батареи.
- Аккумуляторы Silver — имеют чуть более высокое номинальное напряжение 1,55 В.Их также называют оксидно-серебряными или серебряно-цинковыми батареями. Благодаря стабильному выходному напряжению они используются в устройствах, чувствительных к изменениям напряжения. Протекающие серебряные батареи опасны для окружающей среды, что является большой проблемой при хранении использованных элементов.
Среди вышеописанных типов аккумуляторов наиболее распространены, так называемые «Обычные», которые мы покупаем в магазине как, например,Батарейки типа АА или ААА представляют собой угольно-цинковые батареи или их чуть более дорогие щелочные батареи.
Аккумуляторы имеют то преимущество перед аккумуляторами, что мы можем многократно использовать их энергию. После разрядки их достаточно зарядить с помощью подходящего зарядного устройства, т.е. предназначенного для данного типа аккумуляторов.
Доступны следующие типы батарей.
- Свинцово-кислотные аккумуляторы – чаще всего они используются в автомобилях. Каждая батарея состоит из отдельных ячеек с номинальным напряжением 2 В.Большинство аккумуляторов состоят из 3-6 элементов, что дает напряжение аккумулятора 6 или 12 В. Они относятся к группе дешевых аккумуляторов и при необходимости могут обеспечить большой ток (например, для запуска двигателя). Их недостатком является достаточно большая масса на единицу емкости. Они либо необслуживаемые, либо необслуживаемые - то есть без доступа к ячейкам. Подгруппой этого типа аккумуляторов являются AGM-аккумуляторы, в которых электролит поглощается сепаратором из стекломата. Такой вид заполнения межэлектродного пространства предотвращает вытекание электролита из механически поврежденного аккумулятора.Аккумуляторы AGM используются в системах ИБП.
- Гелевые аккумуляторы - электролитом в этом типе аккумуляторов является гелеобразная серная кислота. Преимуществом гелевых аккумуляторов является хорошая устойчивость к потере электролита при работе от электричества и низкий саморазряд. Гелевые аккумуляторы имеют на сегодняшний день самый долгий срок службы — около 12 лет, а также максимально возможное количество циклов заряда/разряда. Кроме того, они отличаются хорошей устойчивостью к внешним температурным перепадам, что в нашем переменчивом климате является довольно весомым преимуществом.К сожалению, они определенно дороже своих свинцово-кислотных собратьев.
- Аккумулятор NiCd (никель-кадмиевый) - номинальное напряжение аккумуляторов Ni-Cd составляет 1,2 В. Аккумуляторы Ni-Cd характеризуются хорошими характеристиками в приложениях, требующих более высоких токов и/или низких температур. Помимо этих особенностей, они устойчивы к глубокому разряду — даже до 0,9 В. Однако имеют т. н. эффект памяти, возникающий при неправильном использовании данного типа аккумуляторов и связанный с началом зарядки до того, как он полностью разрядится.Он уменьшает емкость аккумулятора, что в конечном итоге выливается в время работы устройства, питающегося от этого аккумулятора. Ni-Cd аккумуляторы до сих пор используются в основном из-за их низкой цены. Они часто встречаются в более дешевых электроинструментах и довольно часто в аварийном и эвакуационном освещении.
- Аккумулятор NiMH (никель-металлогидридный) - имеет номинальное напряжение 1,2 В и не рекомендуется разряжать глубже 1,1 В. Характерной их особенностью является отсутствие эффекта памяти, но они имеют т.н.«Ленивый аккумулятор», в котором напряжение немного падает, когда аккумулятор заряжается до того, как он полностью разрядится. Аккумулятор
- Li-Ion (литий-ионный) - номинальное напряжение одной ячейки 3,7 В. По этой причине данные типы аккумуляторов не могут быть прямыми заменителями вышеописанных никель-кадмиевых или никель-гидридных аккумуляторов. Они используются там, где требуется высокая мощность, а вес и размер должны быть сведены к минимуму. Главное их преимущество – отсутствие эффекта памяти и отсутствие эффекта «ленивой батареи».Так как они чувствительны к перезаряду (может взорваться аккумулятор), процесс зарядки немного жестче, чем в обоих вышеупомянутых случаях. Это делает зарядные устройства для литий-ионных аккумуляторов более сложными по конструкции и, следовательно, более дорогими.
- Литий-полимерный аккумулятор - это тип литий-ионного аккумулятора. Главное преимущество этого типа батареи в том, что она может быть любой формы и относительно тонкой. Это означало, что они широко использовались, например, в мобильных телефонах и других мобильных устройствах.Литий-полимерные элементы имеют практически те же свойства, что и литий-ионные аккумуляторы.
- Нанофосфатный аккумулятор - это самый современный тип литий-ионных аккумуляторов. Эти батареи отмечены символом LiFePO4. Они характеризуются номинальным напряжением 3,25 В и очень высокой мощностью и плотностью энергии. Аккумуляторы этих типов нельзя разряжать до напряжения ниже 2 В. Аккумуляторы LiFe-PO4 также имеют очень длительный срок службы.
Использование аккумулятора ограничивается выбором правильной модели, покупкой, установкой в устройство и, после использования, возвратом аккумулятора на утилизацию. В случае с аккумуляторами правил для их корректной работы несколько больше. Аккумуляторы могут быть повреждены по разным причинам, но прежде всего они требуют правильного хранения и зарядки. Для каждого типа батареи требуется свой метод зарядки в зависимости от ее конструкции.По способу управления зарядкой зарядные устройства можно разделить на тактовые и процессорные. Прежде чем выбрать аккумулятор, вы всегда должны учитывать, какой тип будет наиболее подходящим для вашего приложения, будет ли он использоваться ежедневно или только изредка, требует ли устройство, питаемое от него, большой ток, каковы максимальные размеры и форма? Зная ответы на эти вопросы и специфику конструкции и параметров отдельных типов аккумуляторов, можно только осознанно и правильно выбрать нужный аккумулятор.Напоследок стоит подчеркнуть, что ни в коем случае нельзя выбрасывать аккумуляторы и батарейки в мусор. Всегда сдавайте использованные элементы в пункт сбора для этого типа устройств, откуда они отправляются на переработку. Пункты сбора использованных батареек и аккумуляторов можно найти, например, в магазинах или магазинах товаров для дома или инструментов, поэтому доступ к такого рода пунктам очень распространен. Этот метод утилизации связан с тем, что батареи или аккумуляторы содержат тяжелые металлы (например, свинец, кадмий, ртуть) и кислоты или основания, образующие электролит, которые обладают едкими и коррозионными свойствами.Это представляет угрозу для жизни людей и окружающей среды. Поэтому стоит проверить, нет ли их у нас дома, прежде чем совершить очередную покупку аккумулятора или аккумулятора. Также стоит заменить батареи на перезаряжаемые батареи, потому что их можно перезаряжать много раз и, следовательно, использовать дольше. Такие действия определенно ограничат количество аккумуляторов, размещаемых на рынке, а значит, и снизят их вредное воздействие на окружающую среду.
Роберт Габрисяк
.