Что будет если налить воду в кислоту
Что льют кислоту в воду или наоборот. Неправильное смешивание концентрированной серной кислоты с водой (как это выглядит на практике)
Как смешать два жидких вещества? Например, какую-нибудь кислоту и воду? Казалось бы эта задача из серии «дважды два – четыре». Что может быть проще: слить две жидкости вместе, в какой-нибудь подходящей емкости, и все дела! Или влить одну жидкость в емкость, где уже находится другая. Увы, это та самая простота, которая, по меткому народному выражению, хуже воровства. Поскольку дело может закончиться крайне печально!
Инструкция
Имеется две емкости, в одной из них содержится концентрированная серная кислота, в другой – вода. Как их правильно смешать? Лить кислоту в воду или, наоборот, воду в кислоту? Ценой неверного решения в теории может стать низкая оценка, а на практике - в лучшем случае, сильный ожог.
Почему? А потому, что концентрированная серная кислота, во-первых, гораздо плотнее воды, а во-вторых, чрезвычайно гигроскопична. Иными словами, она активно поглощает воду. В-третьих, это поглощение сопровождается выделением большого количества тепла.
Если в емкость с концентрированной серной кислотой начнут приливать воду, первые же порции воды «растекутся» по поверхности кислоты (поскольку вода гораздо менее плотная), и кислота начнет жадно поглощать ее, выделяя тепло. А этого тепла будет так много, что вода буквально «вскипит» и брызги полетят во все стороны. Естественно, не миновав незадачливого экспериментатора. Обжечься и «чистым» кипятком не очень приятно, а если учесть, что в водяных брызгах наверняка будет еще кислота. Перспектива становится совсем невеселой!
Именно поэтому многие поколения учителей-химиков заставляли своих учеников буквально зазубривать правило: «Сначала вода, потом – кислота! Иначе случится большая беда!» Концентрированную серную кислоту следует добавлять в воду, маленькими порциями, при перемешивании. Вот тогда вышеописанная неприятная ситуация не произойдет.
Резонный вопрос: с серной-то кислотой понятно, а как быть с другими кислотами? Как правильно смешивать их с водой? В каком порядке? Необходимо знать плотность кислоты. Если она плотнее воды, например, концентрированная азотная, ее точно так же, как серную, следует приливать в воду, соблюдая вышеуказанные условия (понемногу, при перемешивании). Ну, а если плотность кислоты очень незначительно отличается от плотности воды, как в случае с уксусной кислотой, тут уж без разницы.
Внимание, только СЕГОДНЯ!
Все интересное
Повышенное внимание и осторожность, а также соблюдение особых мер безопасности - необходимое условие при работе с кислотами. К работе с кислотами допускаются лица, достигшие 18 лет, при этом обязательным условием является прохождение курса…
Сернистая кислота - это неорганическая кислота средней силы. Из-за неустойчивости нельзя приготовить ее водный раствор с концентрацией более 6%, иначе она начнет распадаться на серный ангидрид и воду. Химические свойства сернистой кислотыСернистая…
Серная кислота - маслянистая бесцветная жидкость, не имеющая запаха. Относится к сильным кислотам и растворяется в воде в любых соотношениях. Имеет колоссальное применение в промышленности. Серная кислота - довольно тяжелая жидкость, ее плотность…
Серная кислота по физическим свойствам – тяжелая маслянистая жидкость. Она не имеет запаха и цвета, гигроскопична, хорошо растворяется в воде. Раствор с содержанием h3SO4 менее 70% обычно называют разбавленной серной кислотой, более 70% –…
Хлористоводородная (соляная, HCl) кислота – это бесцветная, очень едкая и ядовитая жидкость, раствор хлорного водорода в воде. При сильной концентрации (38% от общей массы при температуре 20оС окружающей среды) - «дымится», туман и пары…
Серная кислота имеет химическую формулу h3SO4. Это тяжелая маслянистая жидкость, бесцветная или с желтоватым оттенком, который ей придают примеси ионов металлов, например, железа. Серная кислота очень гигроскопична, легко поглощает водяные пары.…
Серная кислота входит в пятерку самых сильных кислот. Необходимость в нейтрализации этой кислоты возникает, в частности, в случае ее утечки и при возникновении угрозы отравления ей. Инструкция 1Молекула серной кислоты состоит из двух атомов…
С давних времен, объясняя, как смешивать концентрированную серную кислоту с водой, учителя заставляли учеников запоминать правило: «Сначала вода, потом – кислота!» Дело в том, что если поступить наоборот, первые же порции более легкой…
Серная кислота, имеющая химическую формулу h3SO4, представляет собою тяжелую, плотную жидкость маслянистой консистенции. Очень гигроскопична, легко смешивается с водой, при этом обязательно следует лить кислоту в воду, ни в коем случае не наоборот.…
В любом автомобиле есть источник тока, этим источником является аккумулятор. Т. к. аккумулятор – это элемент многоразового использования, то его можно подзаряжать и менять в нем электролит. Раньше, в автомобилях применялись как кислотные, так и…
Сульфаты железа – это неорганические химические вещества, они делятся на разновидности. Существует двухвалентный сульфат железа(2) и трехвалентный сульфат железа(3). Есть много способов получения этих сернокислых солей. Вам понадобитсяЖелезо,…
Что происходит, если кислоту соединить с какой-либо солью? Ответ на этот вопрос зависит от того, какая это кислота и какая соль. Химическая реакция (то есть превращение веществ, сопровождающееся изменением их состава) между кислотой и солью может…
Как смешать два жидких вещества? Например, какую-нибудь кислоту и воду? Казалось бы эта задача из серии «дважды два – четыре». Что может быть проще: слить две жидкости вместе, в какой-нибудь подходящей емкости, и все дела! Или влить одну жидкость в емкость, где уже находится другая. Увы, это та самая простота, которая, по меткому народному выражению, хуже воровства. Поскольку дело может закончиться крайне печально!
Инструкция
Имеется две емкости, в одной из них содержится концентрированная серная кислота, в другой – вода. Как их правильно смешать? Лить кислоту в воду или, наоборот, воду в кислоту? Ценой неверного решения в теории может стать низкая оценка, а на практике - в лучшем случае, сильный ожог.
Почему? А потому, что концентрированная серная кислота, во-первых, гораздо плотнее воды, а во-вторых, чрезвычайно гигроскопична. Иными словами, она активно поглощает воду. В-третьих, это поглощение сопровождается выделением большого количества тепла.
Если в емкость с концентрированной серной кислотой начнут приливать воду, первые же порции воды «растекутся» по поверхности кислоты (поскольку вода гораздо менее плотная), и кислота начнет жадно поглощать ее, выделяя тепло. А этого тепла будет так много, что вода буквально «вскипит» и брызги полетят во все стороны. Естественно, не миновав незадачливого экспериментатора. Обжечься и «чистым» кипятком не очень приятно, а если учесть, что в водяных брызгах наверняка будет еще кислота. Перспектива становится совсем невеселой!
Именно поэтому многие поколения учителей-химиков заставляли своих учеников буквально зазубривать правило: «Сначала вода, потом – кислота! Иначе случится большая беда!» Концентрированную серную кислоту следует добавлять в воду, маленькими порциями, при перемешивании. Вот тогда вышеописанная неприятная ситуация не произойдет.
Резонный вопрос: с серной-то кислотой понятно, а как быть с другими кислотами? Как правильно смешивать их с водой? В каком порядке? Необходимо знать плотность кислоты. Если она плотнее воды, например, концентрированная азотная, ее точно так же, как серную, следует приливать в воду, соблюдая вышеуказанные условия (понемногу, при перемешивании). Ну, а если плотность кислоты очень незначительно отличается от плотности воды, как в случае с уксусной кислотой, тут уж без разницы.
В разделе на вопрос Что произойдет если кислоту налить в воду, и наоборот если воду в кислоту заданный автором Профайл удалён лучший ответ это Нужно наливать серную кислоту в воду тогда все будет ОК.
А если наоборот... то как минимум разорвет пробирку, а как максимум - тебе будет больно, когда начнет кис-та брызгать и обжигать тебя.
вода легче серной кислоты. Температура плавления равна 10,37 °С при теплоте плавления 10,5 кДж/моль. Это много. - если вливать воду в серную кислоту, то вода закипит в процессе вливания и начнет разбрызгиваться.
Ответ от Дёминов Анатолий [гуру]
Начинает кипеть и брызгаться...
Ответ от электросварщик [гуру]
реакция))) но при наливании воды в кислоту лучше близко не стоять и не вдыхать и глазки туды не засовывать.... перами обозжет
Ответ от Невроз [гуру]
слышали такое выражение кислота ходит в гости...
Ответ от Колосовые [гуру]
слабый раствор кислоты либо воды... =))
Ответ от Їерчилль [гуру]
Второе можно производить только в комбинезоне химзащиты.
Ответ от Анатолий Подплетний [гуру]
В первом случае-кислота тяжелее и сразу уходит на дно остается только помешать и будет элекролит! А во втором случае легкая вода начнет разбрызгивать и повыжигает глаза если нет очков!!
Ответ от ****** [гуру]
То ли будешь зрячая - то ли наоборот! Воду в кислоту - НЕЛЬЗЯ КАТЕГОРИЧЕСКИ! Выброс в виде брызг - глаза - лицо - ожоги -слепота - потеря красоты - инвалид по дурости!!
Ответ от Михаил Бармин [гуру]
Диссоциация (растворение происходит с выделением большого количества тепла. На до вливать вещество с большей плотностью в вещество с меньше плотностью, что приведет к лучшему перемешиванию и меньшей скорости, иначе ВЫБРОС раствора и ПОРАЖЕНИЕ ГЛАЗ!!
Ответ от Ира Юшинова [новичек]
Смотря какую кислоту. В случае с азотной и соляной ничего страшного не произойдет, кислоты просто нагреются. Соляная нагреется сильнее. В случае с серной реакция будет идти с большим выделением тепла. В первом случае серная кислота опустится на дно, так у воды меньшая плотность и реакция будет проходить безопасно. Во втором случае реакция будет проходить на поверхности с большим выделением тепла. Похожее происходит, когда на раскаленную сковородку капнуть воды. Но в конце концов кислота поглотит воду.
Вы помните это правило безопасности , рассказанное на школьных уроках химии?
Я тут подумал намедни, а ЧТО будет с Германией и её "швулями" при ВЛИВАНИИ в эту страну концентрированного потока исламистов ?
Как вы думаете, получится раствор или взрыв ?!
Возможно вы спросите, а кто такие немецкие "швули" ?
Послушайте рассказ этой девушки:
По утверждению самих немцев, количество "швулей" в Германии уже давно перевалило за миллион человек !
В 2001 году, 14 лет назад, немецкое правительство и церковь узаконили гомосексуальные браки . Как результат, в Германии более 400 тысяч только официально зарегистрированных однополых браков .
Рост мужского гомосексуализма прямо пропорционален росту эмансипации.

Это Германия, XXI век.
Немецкому обществу навязан очередной миф и стереотип. Сегодня немецкое общество - это общество социальной амнезии. Ему свойственны безропотное следование приказам и установкам, индифферентность личности, комформизм на пару с униформизмом и духовное порабощение. А так же резкий перепад духовного климата (сегодня ещё здравствуют люди, помнящие, как гомосексуалистов сажали в КZ). И это покорно-бездумное состояние человека «массы» сделало его лёгкой добычей демагогии и предрассудка.
Декларируя всеобщее равенство, демократия не терпит разнообразия, если речь не идёт о гомосексуалистах, транссексуалах и травеститах. Им позволена «цветущая множественность» , а остальных гуманно придушат подушкой политкорректности. На гомосексуализм сегодня в Германии стандартное нейрофизиологическое реакция, как и на все приказы, что спускаются сверху.
Приказано любить - полюбим. Семьдесят лет назад приказали не любить - нелюбили.
Гомосексуализм в Германии стал маргинальным феноменом общественной жизни. В атмосфере вседозволенности он превратился в пандемию.

Институт семьи рухнул под совместным натиском гомосексуалистов, феминисток и атеистов. Мораль и традиция выдавлены в маргинез.
Не только в Германии, но и в других странах мира усилились приметы тотальной болезненности.
Человечество все больше отдаляется от той нормы, которую Эрих Фромм называл «здоровой». Приметами такой жизни являются все возрастающая отчужденность между людьми, усиление эгоцентризма, релятивизация и разрушение традиционных морально-этических ценностей, нарастающая хаотичность жизни, гедонизм и меркантилизм. Источник.
Это была одна сторона медали , а это другая. Она называется "вливание концентрированного потока мусульман в Германию" :

И если вновь прибывшие мусульмане вот так обходятся с полицейскими Германии, то я даже представить себе не могу, какая будет у них реакция на немецких "швулей" !
А ведь и те, и другие в равной степени пригреты и обласканы правительством новой Германии!
На мой взгляд, такая "забота" о немецкой нации со стороны канцлера Германии Ангелы Меркель, это на порядок круче замысел, чем чья-то задумка свести в России воедино бойцов ВДВ и питерских геев!

Как думаете, друзья, смогут ли мусульмане вылечить Гейропу и Германию от содомии ?
АНЕКДОТ в ТЕМУ от Владимира Вольфовича:
Однажды утром Штирлиц зашёл к Мюллеру. Настроение у того было мрачнее тучи.
— Господин группенфюрер, что случилось? Русские уже в пригородах Берлина?
— Штирлиц, бросьте ваши дурацкие шутки! Мне приснился страшный сон — Германия 2015 года!
— И что же, там всё так плохо?
— Не то слово! Представляете, у нас в Германии канцлер — баба, министр иностранных дел — педераст, на заводах Даймлер-Бенц работают турки, Германия оплачивает долги греков и испанцев, вместо факельных шествий — гей-парады, мы платим деньги евреям и выполняем команды негра из Америки!
При смешивании концентрированной серной кислоты и воды выделяется много тепла. Для химика этот факт очень важен, поскольку и в лаборатории, и в промышленности часто приходится готовить разбавленные растворы серной кислоты. Для этого нужно смешивать концентрированную серную кислоту с водой - не всегда, но часто.
Как смешать концентрированную серную кислоту и воду ?
Во всех учебниках и практикумах настоятельно рекомендуют лить серную кислоту в воду (тонкой струйкой и при хорошем перемешивании) - а не наоборот: нельзя лить воду в концентрированную серную кислоту!
Почему? Серная кислота более тяжелая, чем вода.
Если лить кислоту тонкой струйкой в воду, то кислота опустится на дно. Тепло, которое выделится при смешивании, рассеется - пойдет на нагрев всей массы раствора, поскольку над слоем кислоты, которая опустилась на дно сосуда, расположено большое количество воды.
Тепло рассеется, раствор нагреется - и ничего плохого не произойдет, особенно, если в процессе добавлении кислоты к воде жидкость хорошо перемешивать.
А что будет, если сделать неправильно , - в концентрированную серную кислоту добавить воду? Когда первые порции воды попадут в серную кислоту, они останутся на поверхности (поскольку вода легче, чем концентрированная серная кислота). Выделится много тепла, которое пойдет на нагрев маленького количества воды.
Вода резко вскипит, в результате полетят брызги серной кислоты и образуется едкий аэрозоль. Эффект может быть примерно такой, как при добавлении воды на горячую сковородку с маслом. Брызги серной кислоты могут попасть в глаза, на кожу и одежду. Аэрозоль серной кислоты не только очень неприятен при вдыхании, но и опасен для легких.
Если стекло не термостойкое - сосуд может треснуть.
Чтобы это правило было легче запомнить, придумывают специальные стишки вроде:
"Сначала вода, а потом кислота - иначе случиться большая беда!".
Используют также специальные фразы для запоминания - "мемы", например:
"Чай с лимоном".
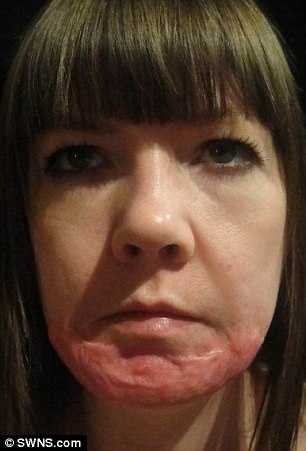
Книги - хорошо, но решил заснять, как выглядит результат неправильного смешивания концентрированной серной кислоты и воды на практике.
Разумеется, со всеми мерами предосторожности: начиная от защитных очков, заканчивая использованием небольших количеств веществ.
Провел несколько экспериментов - я пробовал смешивать серную кислоту с водой (и правильно, и неправильно). Во обоих случаях наблюдался лишь сильный разогрев. А закипания, разбрызгивания, и подобного не происходило.
Для примера, опишу один из экспериментов, проведенный в пробирке. Концентрированной серной кислоты взял 20 мл, воды 5 мл. Обе жидкости комнатной температуры.
Начал добавлять к серной кислоте воду. Вода закипела лишь в момент, когда приливал первые порции воды к кислоте. Новые порции воды погасили кипение. Едкий аэрозоль полетел (к этому я был не готов, пришлось на несколько секунд отойти). Попробовал перемешать алюминиевой проволочкой (то, что было под рукой). Эффекта ноль. Измерил температуру термометром. Оказалось 80 градусов по Цельсию. Эксперимент удался едва ли.
Новый эксперимент провел в колбе: чтобы поверхность соприкосновения двух жидкостей была максимальной (это обеспечит более резкое выделение тепла), а толщина слоя воды над серной кислотой - минимальной. Воду добавлял не всю сразу, а небольшими порциями (чтобы тепло пошло на кипение воды, а не на нагрев всей массы воды).
Итак, в коническую колбу налил около 10-15 мл концентрированной серной кислоты. Воды использовал около 10 мл.
Пока готовился к опыту, кислота под палящим солнцем разогрелась до 36-37 градусов (что градусов на 20 выше, чем начальная температура кислоты в прошлом опыте). Вода в пробирке тоже слегка нагрелась, но не так сильно. Думаю, это сыграло большую роль в успехе опыта.
При добавлении основной порции воды в серную кислоту заметно летели брызги и едкий аэрозоль. К счастью, их сносило ветром, который дул с моей стороны, поэтому я даже ничего не ощутил.
В итоге, температура в пробирке поднялась выше 100 градусов!
Какие можно сделать выводы? Если нарушить правило, что нельзя добавлять воду к концентрированной серной кислоте , разбрызгивание происходит не всегда, но оно возможно - особенно, когда вода и кислота теплые. Особенно - если добавлять воду медленно, небольшими порциями и в широкой посуде.
При работе с бОльшими количествами воды и кислоты вероятность резкого разогрева и разбрызгивания возрастает (напоминаю: мы взяли всего несколько миллилитров).
Опыт, который демонстрирует, что нельзя добавлять воду в концентрированную серную кислоту , описан в практикуме авторов Рипан и Четяну .
Приведу цитату:
Если в концентрированную серную кислоту наливать воду, то первые капли воды, попавшие в нее, моментально превращаются в пар и из сосуда вылетают брызги жидкости. Это происходит по той причине, что вода, обладая небольшим удельным весом, не погружается в кислоту, а кислота ввиду малой теплоемкости не поглощает выделившейся теплоты. При вливании горячей воды наблюдается более сильное разбрызгивание серной кислоты.
Опыт . Смешивание воды с концентрированной Н 2 SO 4 . Стаканчик с концентрированной серной кислотой ставят на дно большого стакана, прикрытого воронкой. Теплую воду вливают при помощи пипетки (рис. 161). При вливании горячей воды внутренние стенки большого стакана и воронки моментально покрываются брызгами жидкости.
Рис. 161
За неимением стеклянной воронки можно воспользоваться картонной, внутрь которой вводят пипетку с водой.
Если в стакан с водой приливать по каплям или тонкой струей концентрированную серную кислоту, то можно заметить, как более тяжелая серная кислота опускается на дно стакана.
При смешивании концентрированной Н 2 SO 4 со льдом можно одновременно наблюдать два явления: гидратацию кислоты, сопровождающуюся выделением тепла, и плавление льда, сопровождающееся поглощением тепла. Поэтому в результате смешивания можно наблюдать либо повышение, либо понижение температуры. Так, при смешивании 1 кг льда с 4 кг кислоты температура повышается почти до 100°, а при смешивании 4 кг льда с 1 кг кислоты температура снижается почти до -20°.
Разбрызгивание кислоты - Справочник химика 21
Физические свойства. Серная кислота — тяжелая бесцветная маслянистая жидкость. Крайне гигроскопична. Поглощает влагу с выделением большого количества теплоты, поэтому нельзя воду прилипать к концентрированной кислоте — произойдет разбрызгивание кислоты. Для разбавления надо серную кислоту приливать небольшими количествами к воде- [c.183]При разбавлении кислот, особенно серной и азотной, нужно добавлять кислоту к воде, а не воду к кислоте. Если добавлять воду к кислоте, происходит вскипание воды и разбрызгивание кислоты. [c.16]
Серная кислота, смещиваясь с водой, выделяет большое количество тепла. При смешении кислоты с водой нужно понемногу обязательно лить кислоту в воду, все время размешивая жидкость. При этом кислота, будучи тяжелее воды, опускается вниз, и раствор нагревается равномерно. Если же наливать воду в кислоту, то вода, оставаясь сверху, будет разогреваться, быстро превращаться в пар и вызовет разбрызгивание кислоты. Конечно, смешивать кислоту с водой следует обязательно в спецодежде, в очках и резиновых перчатках. [c.95]
При разбавлении серной кислоты водой выделяется значительное количество теплоты. Поэтому оно требует осторожности и соблюдения следующего правила серную кислоту следует наливать в воду, чтобы вьщеляемая теплота распределялась по возможности равномерно и не вызывала разбрызгивания кислоты. [c.310]
При разбавлении концентрированной серной кислоты следует медленно и осторожно приливать кислоту в воду, но не наоборот. При разбавлении кислоты выделяется большое количество тепла, поэтому при при-ливании воды к кислоте может произойти разбрызгивание кислоты. [c.42]
Для разбавления концентрированной серной кислоты ее следует тонкой струей вливать в воду, перемешивая при этом раствор воду нельзя приливать к кислоте, так как это вызовет вскипание и сильное разбрызгивание кислоты. Разбавленная кислота занимает меньший объем, чем ее составляющие, причем эффект сокращения объема максимален при соотношении Н23 04 Н20=1 2 [(Нз0)2(504) ]. [c.219]
При растворении минеральных кислот, особенно серной и азотной, нужно придерживаться правила серную или азотную кислоту добавлять к воде, но не наоборот. При добавлении воды к кислоте, особенно концентрированной серной, можно получить сильные ожоги в результате разбрызгивания кислоты. [c.132]
При растворении концентрированной кислоты в воде в растворе сразу образуется большое количество ионов водорода, которые гидратируются с большим выделением теплоты. Поэтому, если смешать 1 моль НаЗО, с необходимым для полной гидратации протонов количеством воды (> 100 моль Н2О), выделяющейся теплоты (81,5 кДж) будет достаточно, чтобы нагреть раствор на 20 градусов. Если же количество воды мало, а кислоты - велико, то в месте контакта температура повышается настолько, что происходит испарение части воды и может произойти разбрызгивание кислоты. [c.271]
Нельзя наливать воду в серную кислоту Приливать кислоту к воде следует осторожно. Особенно осторожно следует обращаться с концентрированной серной кислотой, т. к. при этом возможно разбрызгивание кислоты вследствие бурной реакции гидратации. [c.55]
Выполнение определения. Навеску измельченного сплава растворяют в азотной кислоте (плотность 1,2 г/см ) в фарфоровой выпарительной чашке при слабом нагревании. Во время растворения чашка должна быть накрыта часовым стеклом во избежание разбрызгивания кислоты. Полученный раствор выпаривают на [c.246]
Разбавляя серную кислоту, следует приливать ее в воду, а не наоборот, во избежание ожогов из-за разбрызгивания кислоты. Концентрированные кислоты (азотную, серную, хлорсульфоновую и др.), а также сильнодействующие реактивы (например, бром, хлороформ) необходимо хранить и переливать под тягой в вытяжных шкафах. [c.202]
Выполнение определения. Навеску измельченного сплава растворяют в азотной кислоте (плотность 1,2 г/см ) в фарфоровой выпарительной чашке при слабом нагревании. Во время растворения чашка должна быть накрыта часовым стеклом во избежание разбрызгивания кислоты. Полученный раствор выпаривают на водяной бане почти досуха, разбавляют водой, добавляют еще 2—3 мл 6 н. азотной кислоты, 1 жл индикатора и титруют в той же чашке раствором роданида аммония. [c.294]
Для разбавления кислоты нужно медленно закачивать ее в воду, а не наоборот, чтобы избежать сильного разогрева и разбрызгивания кислоты. [c.30]
Запрещается в емкостях для хранения кислоты производить ее разбавление или смешение растворов кислот с большой разницей в концентрациях во избежание выделения тепла и выброса кислоты. Для этой цели необходимо иметь специальные резервуары. Для разбавления кислоту следует медленно закачивать в емкость с водой, а не наоборот, чтобы избежать разогрева и разбрызгивания кислоты. [c.180]
Выполняя опыты, связанные с опасностью взрыва, воспламенения или разбрызгивания кислот и щелочей, помимо соблюдения всех других мер предосторожности, работать стоя. [c.6]
При разбавлении серной кислоты необходимо приливать кислоту к воде, а не наоборот. Смешивание кислоты с водой сопровождается сильным разогреванием, поэтому при добавлении воды в кислоту происходит разбрызгивание кислоты, что очень опасно. Если кислота попала на кожу или одежду, необходимо смыть ее большим количеством воды, а затем нейтрализовать раствором щелочи. [c.15]
Примечание. Необходимо соблюдать осторожность при нитровании незнакомых веществ, так как иногда реакция проходит со взрывом, в результате чего при разбрызгивании кислоты могут иметь место серьезные поражения глаз. [c.280]
Серную кислоту следует сливать через верхний люк посредством сифона. Применять резиновые шланги для сифона запрещается. Для предотвращения разбрызгивания кислоты при сливе ее в бак необходимо устанавливать брызгоуловители. [c.440]
Кислотопроводы должны быть расположены в доступных местах. Если они расположены горизонтально (над уровнем пола), то они должны быть снабжены по всей длине подвесными желобками (ванночками) для предотвращения попадания кислоты на пол при появлении течи. При вертикальном расположении они должны крепиться к стенке через каждые 2. и и должны быть оборудованы специальными щитками, защищающими обслуживающий персонал от разбрызгивания кислоты в случае разрыва кислотопровода. [c.440]
Все краны, расположенные на линии кислотопроводов, должны быть оборудованы приспособлениями, обеспечивающими невозможность разбрызгивания кислоты при любом нарушении нормальной работы крана. [c.440]
Пробирку держат на вытянутой руке над фарфоровой чашкой с кварцевым песком для того, чтобы предупредить разбрызгивание кислоты, если пробирка лопнет. [c.233]
Однако даже при правильном приеме работы — приливании кислоты к воде не исключена возможность случайного разбрызгивания кислоты. Поэтому, смешивая кислоту с водой, следует надевать предохранительные очки. [c.131]
Никогда не следует добавлять воду в концентрйрованную серную кислоту в этом случае выделяется настолько большое количество тепла, что часть воды немедленно вскипает, и это приводит к разбрызгиванию кислоты во все стороны. [c.216]
По окончании работы кран газоотводной трубки закрывают и тогда вся кислота вытесняется выделяющимся газом в шар воронки. Выделение газа обычно продолжается еще некоторое время за счет кислоты, смачивающей реагент, и пузырьки газа пробулькивают через кислоту, находящуюся в воронке. При этом может произойти разбрызгивание кислоты из отверстия воронки. Во избежание этого следует, после того как закроют газоотводный кран, выждать некоторое время, пока нижняя часть аппарата заполнится газом, после чего снова открывают кран для выпуска газа и затем опять закрывают. Чтобы брызги кислоты не вылетали из отверстия шарообразной воронки, в нее вставляют обычную химическую или специальную предохранительную воронку. [c.309]
Вместо глиняного сосуда можно взять большую водяную баню. Мотор не должен стоять непосредственно над нитрующей смесью, так как он портится выделяющимися окислами азота. Мотор должен быть соединен с мешалкой посредством привода. Еще лучше пользоваться мешалкой с приводом от водяной турбины. При невозможности пользоваться вытяжным шкафом реакщ1Ю ведут в трехгорлой 3-литровой колбе, снабженной стеклянной трубкой для отвода газов. Если реакцию ведут в стакане, то его следует прикрыть двумя прямоугольными стеклянными пластинками, что уменьшает возможность разбрызгивания кислоты. [c.317]
Количество хлорной кислоты в рабочей зоне должно быть не больше требуемого для текуш,его исследования. Максимальное количество H IO4, которое может храниться в здании лаборатории,—несколько склянок по 0,454 кг или 2 склянки по 3,2 кг. Обычно для одного анализа достаточно 28.35 г жидкой хлорной кислоты. Каждая колба, применяемая для текуш,ей работы, должна находиться в стеклянной или керамической чашке достаточных размеров, чтобы вместить все содержимое колбы. При разбрызгивании кислоты необходимо смыть жидкость большим количеством воды. Колбы, не находяш,иеся Б работе, должны сохраняться в несгораемых помещениях, отдельно от горючих материалов и химикатов. [c.201]
Производственной воды в кислотогрейке не требуется, смывные краны здесь не устанавливают, так как вода, попав на пролитую кислоту, может вызвать разбрызгивание кислоты, что опасно дл обслуживающего персонала. [c.71]
Армоиб 25 легко растворяется в кислотах. Пена, образуемая при этом, не допускает разбрызгивания кислоты. Вследствие хорошей термостабильнэсти ингибитор мохсно попользовать при высокой температуре. [c.57]
Нельзя наливать води в серную кислоту Добавлять кислоту в воду следует осторожно. Особенно осторожно следует обра щаться с концентрированной серной кислотой, так как при этом возможно разбрызгивание кислоты вследствие бурной реакции гидратации. [c.68]
Весьма характерно отношение серной кислоты к воде. С водой она смешивается в любой пропорции, выделяя много теплоты вследствие образования гидратов Н2504 НаО, Н2504 2НаО и др. При вливании концентрированной серной кислоты в воду кислота благодаря большей, чем у воды плотности, опускается вниз, постепенно смешиваясь с ней. Содержимое сосуда нагревается более или менее равномерно и не слишком сильно из-за большой теплоемкости воды. Если вливать в концентрированную серную кислоту воду, то вода как более легкая жидкость проникнет в кислоту лишь на небольшую глубину. В результате раствор в этом месте может нагреться до кипения, а образующийся пар вызовет разбрызгивание кислоты. [c.102]
Распространенной операцией при работе с кислотами и щелочами является их разбавление водой до нужной концентрации. При взаимодействии серной кислоты и воды выделяется значительное количество тепла. Во избежание бурного вскипания воды и разбрызгивания кислоты необходимо заливать кислоту в воду, а не наоборот. Налив кислоты должен производиться небольшими порциями при непрерывном перемешивании. Технологические операции по разбавлению серной кислоты водой герметизируют, кроме того, проводится постоянный контроль за температурой в аппарате, где прси ходит смешение. [c.50]
На кислотопроводах, работающих под давлением, каждое соединение, расположенное около рабочего места обслуживающего персонала, должно быть снабжено специа11ьным устройством, предохраняющим от разбрызгивания кислоты при прорыве прокладок. [c.173]
Химические ожоги концентрирсванной серной кислотой в химических лабораториях могут быть следствием разбрызгивания кислоты при быстром испарении влитой в нее воды. Известны случаи ожогов лица при мытье посуды, в которую сначала была налита концентрированная кислота, а затем добавлена вода при разогревании, происходящем во время разбавления серной кислоты, температура смеси поднимается значительно выше 100 и, конечно, вода, попавшая в такую жидкость, моментально [c.19]
Соляная кислота: влияние на экологию и здоровье человека. Справка
Получают соляную кислоту растворением в воде хлористого водорода, который синтезируют или непосредственно из водорода и хлора или получают действием серной кислоты на хлорид натрия.
Выпускаемая техническая соляная кислота имеет крепость не менее 31% HCl (синтетическая) и 27,5% HCl (из NaCI). Торговую кислоту называют концентрированной, если она содержит 24% и больше HCl, если содержание HCl меньше, то кислота называется разбавленной.
Соляную кислоту применяют для получения хлоридов различных металлов, органических полупродуктов и синтетических красителей, уксусной кислоты, активированного угля, различных клеев, гидролизного спирта, в гальванопластике. Ее применяют для травления металлов, для очистки различных сосудов, обсадных труб буровых скважин от карбонатов, окислов и др. осадков и загрязнений. В металлургии кислотой обрабатывают руды, в кожевенной промышленности – кожу перед дублением и крашением. Соляную кислоту применяют в текстильной, пищевой промышленности, в медицине и т. д.
Соляная кислота играет важную роль в процессах пищеварения, она является составной частью желудочного сока. Разведенную соляную кислоту назначают внутрь главным образом при заболеваниях, связанных с недостаточной кислотностью желудочного сока.
Транспортируют соляную кислоту в стеклянных бутылях или гуммированных (покрытых слоем резины) металлических сосудах, а также в полиэтиленовой посуде.
Соляная кислота очень опасна для здоровья человека. При попадании на кожу вызывает сильные ожоги. Особенно опасно попадание в глаза.
При попадании соляной кислоты на кожные покрытия ее необходимо немедленно смыть обильной струей воды.
Очень опасны туман и пары хлороводорода, образующиеся при взаимодействии с воздухом концентрированной кислоты. Они раздражают слизистые оболочки и дыхательные пути. Длительная работа в атмосфере HCl вызывает катары дыхательных путей, разрушение зубов, помутнение роговицы глаз, изъязвление слизистой оболочки носа, желудочно-кишечные расстройства.
Острое отравление сопровождается охриплостью голоса, удушьем, насморком, кашлем.
В случае утечки или разлива соляная кислота может нанести существенный ущерб окружающей среде. Во-первых, это приводит к выделению паров вещества в атмосферный воздух в количествах превышающих санитарно-гигиенические нормативы, что может повлечь отравление всего живого, а также появлению кислотных осадков, которые могут привести к изменению химических свойств почвы и воды.
Во-вторых, она может просочиться в грунтовые воды, в результате чего может произойти загрязнение внутренних вод.
Там, где вода в реках и озерах стала довольно кислой (рН менее 5) исчезает рыба. При нарушении трофических цепей сокращается число видов водных животных, водорослей и бактерий.
В городах кислотные осадки ускоряют процессы разрушения сооружений из мрамора и бетона, памятников и скульптур. При попадании на металлы соляная кислота вызывает их коррозию, а, реагируя с такими веществами, как хлорная известь, диоксид марганца, или перманганат калия, образует токсичный газообразный хлор.
В случае разлива соляную кислоту смывают с поверхностей большим количеством воды или щелочного раствора, который нейтрализует кислоту.
Материал подготовлен на основе информации открытых источников
Кислоты
3. КИСЛОТЫ
Кислотами называются сложные вещества, состоящие из атомов водорода и кислотных остатков.
С точки зрения теории электролитической диссоциации кислоты это электролиты, диссоциирующие в водных растворах на катионы только водорода Н+ и анионы кислотных остатков.
Если кислота одноосновная, то она диссоциирует в одну ступень:
HCI H+ + CI
HNO3 H+ + NO3
Если кислота многоосновная, то она диссоциирует ступенчато:
H3PO4 H+ + H2PO4 (первая ступень),
H2PO4 H+ + HPO42 (вторая ступень),
HPO42 H+ + PO43 (третья ступень).
Ступенчатой диссоциацией многоосновных кислот объясняется образование кислых солей.
Номенклатура кислот.
1. Бескислородные кислоты
В бескислородных кислотах называется кислотообразующий элемент и добавляется окончание водородная:
HCl хлороводородная кислота
H2S сероводородная кислота
2. Кислородосодержащие кислоты.
Составление названий кислородосодержащих кислот рассмотрим на следующих примерах:
H2SO4 серная кислота,
H3AsO4 мышьяковая кислота.
Называется кислотообразующий элемент с суффиксом н или ов (если степень окисления элементов максимальная).
Если степень окисления элемента промежуточная, то в названии используется еще и суффикс ист:
H2SO3 сернистая кислота,
H3AsO3 мышьяковистая кислота.
Когда элемент образует много кислородсодержащих кислот (например, хлор), то, по мере убывания степени окисления кислотообразующего элемента, они имеют следующие названия:
HO4 хлорная кислота;
HO3 хлорноватая кислота;
HO2 хлористая кислота;
HO хлорноватистая кислота.
Иногда в молекулах кислородосодержащих кислот элемент имеет одинаковую степень окисления, тогда в названии используются приставки, которые указывают на различное содержание воды в кислоте:
мета - мало воды,
орто - много воды.
Например:
P2O5 + H2O → 2HO3 метафосфорная кислота,
P2O5 + 3H2O → 2H3O4 ортофосфорная кислота.
При составлении формул придерживаются следующих правил:
1. Бескислородные кислоты.
Зная название кислоты, записываем сначала водород, а затем кислотообразующий элемент. Степень окисления водорода в кислотах всегда +1. Степень окисления элемента отрицательная. Она равна номеру группы ПСЭ (в которой находится элемент) минус восемь.
Например: сероводородная кислота элемент сера, расположен в шестой группе ПСЭ. 6 - 8 = -2. Степень окисления серы 2. Записываем символы водорода и серы Н+S-2, т.к. молекула электронейтральна, то формула кислоты будет Н2S.
2. Кислородсодержащие кислоты.
По суффиксам в названии кислоты определяем степень окисления кислотообразующего элемента. Эта степень окисления сохраняется в кислотном оксиде. По приставке в названии определяем количество воды в кислоте.
Например: метафосфорная кислота кислотообразующий элемент фосфор. Суффикс н показывает, что он имеет максимальную степень окисления, фосфор в пятой группе ПСЭ, следовательно, максимальная степень окисления +5, она сохраняется и в оксиде фосфора Р2+5О5-2. Приставка мета говорит о том, что воды в кислоте минимальное количество.
В формулах кислородосодержащих кислот сначала записывается водород, затем кислотообразующий элемент и кислород. Индексами выравнивают число положительных и отрицательных зарядов. Если они четные, то их сокращают и ставят перед формулой соответствующий коэффициент.
+5 -2
P2O5 + H2O → H2P2O6 → 2HPO3 метафосфорная кислота,
+5 -2
P2O5 + 2H2O → H4P2O7 пирофосфорная кислота,
+5 -2
P2O5 + 3H2O → H6P2O8 → 2H3PO4 ортофосфорная кислота.
Классификация кислот по следующим признакам:
По содержанию кислорода:
1. Кислородосодержащие 2. Бескислородные
HNO3, H2SO4, H3PO4 HCl, HJ, H2S
По основности
(по числу атомов водорода в молекуле кислоты)
1. Одноосновные 2. Многоосновные
HCl, HNO3, HBr H2SO4, H3PO4, H2S
По силе (по степени диссоциации)
1. Сильные (α =100 %) 2. Слабые (α < 100 %)
HCl, HNO3, H2SO4 H2S, HNO2, H2CO3
По растворимости
1. Растворимые 2. Нерастворимые
HCl, HNO3 H2SiO3, H2MoO4
Получение
1. Бескислородные кислоты получают синтезом из простых веществ летучих соединений с последующим растворением их в воде. Например:
H2 + Cl2 → 2HCl хлороводород, газ. Растворяем его в воде, получаем HCl хлороводородную кислоту жидкость.
2. Растворение соответствующего оксида в воде:
P2O5 + 3H2O → 2H3PO4.
3. Электролиз растворов солей:
Na2SO4 + 4H2O H2SO4 +2H2+O2+2NaОН.
4. Взаимодействие растворимой соли с сильной кислотой (получают нерастворимые, легколетучие, слабые кислоты):
Na2SiO3 + 2HCl → 2NaCI + H2SiO3
H2O
Na2CO3 + 2HCl → 2NaCI + H2 CO3
CO2
Физические свойства
Большинство неорганических кислот жидкости, смешивающиеся с водой в любых соотношениях, затвердевающие при низких температурах; фосфорная кислота - кристаллическое, похожее на лед вещество, хорошо растворяется в воде. Кремниевая кислота твердое вещество, нерастворимое в воде. Некоторые кислоты существуют только в растворе H2Cr2O7, HMnO4. Их гидратированные анионы окрашены в характерные цвета: оранжевый, фиолетовый. Наконец, такие кислоты, как хлороводородная, бромоводородная летучие, поэтому обладают резким запахом. Кислоты имеют кислый вкус.
Химические свойства
1. Изменение цвета индикаторов:
фенолфталеин бесцветный,
лакмус розовый,
метилоранж красный.
2. Взаимодействие с основаниями с образованием соли и воды (реакция нейтрализации):
H2SO4 + 2NaOH → Na2SO4 + 2H2O.
3. Взаимодействие с основными оксидами:
H2SO4 + Na2O → Na2SO4 + 2H2O.
4. Взаимодействие с солями:
а) менее летучие кислоты вытесняют более летучие из их солей:
H2SO4 + NaCI → NaHSO4 + HCI
конц. тверд.
б) более сильные кислоты вытесняют менее сильные из растворов их солей:
3HCI + Na3PO4 → 3NaCI + H3PO4.
5. Взаимодействие с металлами различных кислот протекает согласно положению металлов в ряду напряжений, который характеризует окислительно-восстановительную способность электрохимической системы металл - ион металла.
Li К Ca Мg Al Ti Cr Zn Fe Ni Sn Pb H Cu Ag Au
Исходя из этого, все металлы удобно разделить на три условные группы:
| Активные | Средней активности | Малоактивные |
| Li К Ca Мg Al | Ti Cr Zn Fe Ni Sn Pb | Cu Ag Au |
Взаимодействие металлов с хлороводородной кислотой
.
| Активные | Средней активности | Малоактивные |
| Реагируют | Реагируют (пассивируется Pb) | Не реагируют |
Например:
Zn +2HCI → ZnCI2 + H2
Щелочные и щелочноземельные металлы с растворами кислот взаимодействуют в две стадии:
Na + HCI NaCI + H2
1).2Na + 2H2O → 2NaОН + H2
2). NaОН + HCI→ NaCI + H2O.
Малоактивные металлы, расположенные в ряду напряжений правее водорода, из разбавленного раствора кислоты его не вытесняют:
Cu + HCl
Взаимодействие металлов с разбавленной серной кислотой
| Активные | Средней актив. | Малоактивные |
| Реагируют | Реагируют (пассивируется Pb) | Не реагируют |
Например:
Zn + H2SO4 → ZnSO4 + H2
Малоактивные металлы, расположенные в ряду напряжений правее водорода, из разбавленного раствора кислоты его не вытесняют:
Cu + H2SO4
Взаимодействие металлов с концентрированной серной кислотой
| Активные | Средней активности | Малоактивные |
| Реагируют | Реагируют (пассивируются Al, Fe) | Реагируют Сu, Hg не реагируют Ag, Au, Pt |
В результате взаимодействия образуются сульфат металла, вода и один из продуктов окисления серной кислоты:
| S , H2S, SO2 | S , H2S, SO2 | SO2 |
Например: Zn + 2H2SO4(К) → ZnSO4 + SO2 + 2H2O,
4Zn + 5H2SO4(К) → 4ZnSO4 + H2S + 4H2O,
3Zn + 4H2SO4(К) → 3ZnSO4 + S + 4H2O,
2H2SO4(к) + Сu → Сu SO4 + SO2 + 2H2O.
Холодная концентрированная серная кислота пассивирует Al, Fe; при нагревании пассивирующие пленки растворяются, и взаимодействие с кислотой протекает интенсивно.
Взаимодействие металлов с разбавленной азотной кислотой
| Активные | Средней активности | Малоактивные |
| Реагируют | Реагируют (пассивируется Ti) | Реагируют Сu, Hg Ag, не реагируют Au, Pt |
В результате взаимодействия образуются нитрат металла, вода и один из продуктов окисления азотной кислоты:
| NH3, NH4NO3 | N2 или N2O | NO |
Например:
10HNO3 + 4Mg → 4Mg(NO3)2 + NH4NO3 + 3H2O.
Взаимодействие металлов с концентрированной азотной кислотой
| Активные | Средней активности | Малоактивные |
| Реагируют | Реагируют (пассивируются Ti, Al, Cr, Fe) | Реагируют Сu, Hg Ag, не реагируют Au, Pt |
В результате взаимодействия образуются нитрат металла, вода и NO2 (газ бурого цвета). При взаимодействии с кислотой активных металлов возможно выделение N2O.
Например:
4HNO3 + Сu → Сu (NO3)2 + 2NO2 + 2H2O.
10HNO3 + 4Са → 4Са (NO3)2 + N2O + 5H2O.
При взаимодействии азотной кислоты любой концентрации и концентрированной серной с металлами водород никогда не выделяется.
Холодная концентрированная азотная кислота пассивирует следующие металлы Fe, Cr, Al, Ti, но при нагревании взаимодействие этих металлов с кислотой протекает энергично.
6. Взаимодействие с неметаллами азотной и концентрированной серной кислот:
3P + 5HNO3 + 2H2O → 3H3PO4 + 5NO,
C + 2H2SO4(к) → CO2 + 2SO2 + 2H2O.
7. При нагревании некоторые кислоты разлагаются:
H2SiO3 H2O + SiO2.
Ход работы:
Опыт № 1. Взаимодействие кислотного оксида
с водой
Стеклянной палочкой взять кусочек оксида фосфора (V) и смешать его с небольшим количеством воды. В полученный раствор добавить 23 капли лакмуса. Написать уравнение реакции.
Опыт № 2. Взаимодействие соли с кислотой
Положить в пробирку немного сухого ацетата натрия
CH3COONa или другой соли уксусной кислоты и добавить небольшое количество разбавленной серной кислоты. Образовавшаяся кислота может быть обнаружена по запаху. При выяснении запаха нельзя нюхать вещество прямо из пробирки, так как вдыхание газов и паров может вызвать сильное раздражение дыхательных путей. Необходимо ладонью руки сделать легкие движения от пробирки к носу. В этом случае в нос будет попадать смесь газа с воздухом и сильного раздражения не произойдет.
В пробирку внести 56 капель концентрированного раствора силиката натрия Na2SiO3 и постепенно добавить 56 капель соляной кислоты, непрерывно встряхивая пробирку. Образуется студнеобразный осадок. Подействовать на полученный осадок раствором щелочи и серной кислоты. Отметить изменения в пробирках и написать уравнения реакций.
Опыт № 3. Взаимодействие основного оксида с кислотой
К небольшому количеству оксида магния в пробирке прилить небольшое количество соляной кислоты. Отметить растворение осадка. Написать уравнения реакции. Какая соль образовалась?
Опыт № 4. Взаимодействие основания с кислотой
(реакция нейтрализации)
Налить в фарфоровую чашку 10 см3 2 моль/дм3 раствора гидроксида натрия. Добавить 12 капли фенолфталеина, чтобы окраска стала малиновой, что подтверждает наличие щелочи в растворе. Затем в пробирку по каплям добавлять раствор соляной кислоты, до обесцвечивания раствора. Выпарить содержимое чашки и убедиться, что образовалась соль. Написать уравнение реакции.
Страница не найдена - Портал Продуктов Группы РСС
Сообщите нам свой адрес электронной почты, чтобы подписаться на рассылку новостного бюллетеня. Предоставление адреса электронной почты является добровольным, но, если Вы этого не сделаете, мы не сможем отправить Вам информационный бюллетень. Администратором Ваших персональных данных является Акционерное Общество PCC Rokita, находящееся в Бжег-Дольном (ул. Сенкевича 4, 56-120 Бжег-Дольный, Польша ). Вы можете связаться с нашим инспектором по защите личных данных по электронной почте: .
Мы обрабатываем Ваши данные для того, чтобы отправить Вам информационный бюллетень - основанием для обработки является реализация нашей законодательно обоснованной заинтересованности или законодательно обоснованная заинтересованность третьей стороны – непосредственный маркетинг наших продуктов / продуктов группы PCC .
Как правило, Ваши данные мы будем обрабатывать до окончания нашего с Вами общения или же до момента, пока Вы не выразите свои возражения, либо если правовые нормы будут обязывать нас продолжать обработку этих данных, либо мы будем сохранять их дольше в случае потенциальных претензий, до истечения срока их хранения, регулируемого законом, в частности Гражданским кодексом.
В любое время Вы имеете право:
- выразить возражение против обработки Ваших данных;
- иметь доступ к Вашим данным и востребовать их копии;
- запросить исправление, ограничение обработки или удаление Ваших данных;
- передать Ваши персональные данные, например другому администратору, за исключением тех случаев, если их обработка регулируется законом и находится в интересах администратора;
- подать жалобу Президенту Управления по защите личных данных.
Получателями Ваших данных могут быть компании, которые поддерживают нас в общении с Вами и помогают нам в ведении веб-сайта, внешние консалтинговые компании (такие как юридические, маркетинговые и бухгалтерские) или внешние специалисты в области IT, включая компанию Группы PCC .
Больше о том, как мы обрабатываем Ваши данные Вы можете узнать из нашего Полиса конфиденциальности.
О едком и не очень / Хабр
– Эти идиоты поместили фарфоровый контейнер со «студнем» в специальную камеру, предельно изолированную… То есть это они думали, что камера предельно изолирована, но когда они открыли контейнер манипуляторами, «студень» пошел через металл и пластик, как вода через промокашку, вырвался наружу, и все, с чем он соприкасался, превращалось опять же в «студень». Погибло тридцать пять человек, больше ста изувечено, а все здание лаборатории приведено в полную негодность. Вы там бывали когда-нибудь? Великолепное сооружение! А теперь «студень» стек в подвалы и нижние этажи… Вот вам и прелюдия к контакту.
— А. Стругацкий, Б. Стругацкий «Пикник на обочине»
Привет, %username%!
В том, что я всё ещё что-то пишу — вините вот этого человека. Он навеял идею.
Просто, немного поразмыслив, я решил, что небольшой экскурс по едким веществам получится относительно быстро. Может кому-то будет и интересно. А кому-то — и полезно.
Поехали.
Сразу определимся с понятиями.
Едкий — 1. Разъедающий химически. 2. Резкий, вызывающий раздражение, боль. 3. Язвительный, колкий.
Ожегов С.И. Словарь русского языка. — М.: Рус.яз., 1990. — 921 с.
Итак, отбрасываем сразу два последних значения слова. Также отбрасываем «едкие» лакриматоры — которые не столько едкие, сколько вызывают слезотечение, и стерниты — которые вызывают кашель. Да, ниже будут вещества, которые обладают и этими свойствами, но они — что главное! — действительно разъедают материалы, а иногда и плоть.
Мы не будем рассматривать вещества, едкие только для человека и подобных — в виду специфического разрушения мембран клеток. А потому иприты останутся не у дел.
Мы будем рассматривать соединения, которые в комнатных условиях — жидкости. Поэтому жидкий кислород и азот, а также газы типа фтора рассматривать не будем, хотя их можно считать едкими, да.
Как обычно, взгляд будет исключительно субъективным, основанным на собственном опыте. И да — вполне возможно, что кого-то я и не упомню — пиши комментарии, %username%, в течение трёх суток с момента публикации я буду дополнять статью тем, что забылось с самого начала!
И да — у меня нет времени и сил строить «хит-парад», поэтому будет сборная солянка. И со всеми исключениями — она вышла довольно короткой.
Едкие щелочи
А конкретно — гидроксиды щелочных металлов: лития, натрия, калия, рубидия, цезия, франция, гидроксид таллия (I) и гидроксид бария. Но:
- Литий, цезий, рубидий и барий отбрасываем — дорого и редко встретишь
- Если ты, %username%, встретишь гидроксид франция, то едкость тебя будет волновать в последнюю очередь — он жутко радиоактивный
- То же и с таллием — он ядовит до жути.
А потому остались натрий и калий. Но будем откровенны — свойства у всех едких щелочей очень схожие.
Гидроксид натрия известен всем как «каустическая сода» (не путать с пищевой, кальцинированной и другими содами, а также поташем). Гидроксид калия как пищевая добавка Е525 — тоже. По свойствам оба похожи: сильно гигроскопичны, то бишь тянут воду, на воздухе «расплываются». Хорошо растворяются в воде, при этом выделяется большое количество теплоты.
«Расплывание» на воздухе — по сути образование очень концентрированных растворов щелочей. А потому, если положить кусочек едкой щёлочи на бумагу, кожу, некоторые металлы (тот же алюминий) — то по прошествии времени обнаружится, что материал хорошо подъело! То, что показывали в «Бойцовском клубе» — очень похоже на правду: действительно, потные руки — да в щёлочь — будет больно! Лично мне показалось больнее, чем от соляной кислоты (о ней ниже).
Впрочем, если руки очень сухие — скорее всего в именно сухой щёлочи ничего и не почувствуешь.
Едкие щёлочи отлично разваливают жиры на глицерин и соли жирных кислот — так и варят мыло (привет, «Бойцовский клуб!») Чуть дольше, но так же действенно расщепляются белки — то есть в принципе щёлочи плоть растворяют, особенно крепкие растворы — да при нагревании. Недостатком в сравнении с той же хлорной кислотой (о ней тоже ниже) является то, что все щёлочи тянут углекислый газ из атмосферы, а потому сила будет постепенно снижаться. Кроме того, щёлочи реагируют и с компонентами стекла — стекло мутнеет, хотя, чтобы его растворить целиком — тут, конечно, надо постараться.
К едким щелочам иногда относят и тетраалкиламмоний гидроксиды, например
Гидроксид тетраметиламмонияНа самом деле в этих веществах объединились свойства катионных поверхностно-активных веществ (ну это как обычное мыло — только катионное: тут активная дифильная частица — с зарядом "+", а в мыле — с зарядом "-") и относительно высокая основность. Если попадёт на руки — можно намылить в воде и помыть, как мылом, если в водном растворе погреть волосы, кожу или ногти — растворятся. «Едкость» на фоне гидроксидов натрия и калия — так себе.
Серная кислота
H2SO4
Самая популярная, наверное, во всех историях. Не самая едкая, но достаточно неприятная: концентрированная серная кислота (которая 98%) — маслянистая жидкость, которая очень любит воду, а потому у всех её отнимает. Отнимая воду у целлюлозы и сахара, обугливает их. Точно так же она радостно отнимет воду и у тебя, %username%, особенно если налить её на нежную кожу лица или в глаза (ну в глаза на самом деле всё будет попадать с приключениями). Особо добрые люди мешают серную кислоту с маслом, чтобы труднее смывалась и лучше впитывалась в кожу.
Кстати, забирая воду, серная кислота здорово разогревается, что делает картину ещё больше сочной. А потому смывать её водой — очень плохая идея. Лучше — маслом (смывать, а не втирать — а потом уже смыть водой). Ну или большим потоком воды, чтобы сразу и охлаждать.
«Сначала вода, а потом кислота — иначе случится большая беда!» — это именно про серную кислоту, хотя почему-то все считают, что про любую кислоту.
Будучи окислителем, серная кислота окисляет поверхность металлов до оксидов. А поскольку взаимодействие оксидов с кислотами проходит при участии воды как катализатора — а воду серная кислота не отдаёт — то происходит эффект, называемый пассивацией: плотная, нерастворимая и непроницаемая плёнка оксида металла защищает его от дальнейшего растворения.
По этому механизму концентрированную серную кислоту посылают в далёкие дали железо, алюминий. Примечательно, что если кислоту разбавить — появляется вода, и посылать не получается — металлы растворяются.
Кстати, оксид серы SO3 растворяется в серной кислоте и получается олеум — который иногда ошибочно пишут как H2S2O7, но это не совсем верно. У олеума тяга к воде ещё больше.
Собственные ощущения от попадания серной кислоты на руку: немного тепло, потом чуток печёт — смыл под краном, ничего страшного. Фильмам не верьте, но на лицо капать не советую.
Органики часто пользуются хромпиком или «хромовой смесью» — это бихромат калия, растворённый в серной кислоте. По сути это — раствор хромовой кислоты, он хорош для мытья посуды от остатков органики. При попадании на руку тоже жжётся, но по сути — серная кислота плюс токсичный шестивалентный хром. Дырок в руке не дождёшься, разве что на одежде.
Автор этих строк знаком с идиотом, который вместо бихромата калия использовал перманганат калия. При контакте с органикой немножко жахнуло. Присутствующие обделались отделались лёгким испугом.
Кстати, раз уж вспомнили хромпик — немного отвлечёмся от темы кислот и
Хлористый хромил
CrO2Cl2
По сути своей — лютое соединение шестивалентного хрома и соляной кислоты. Тёмно-красная жидкость, которая тянет воду, гидролизуется — и в итоге дымит этой самой соляной кислотой. Едкость — итог этого братского единения: хром — окисляет, соляная кислота — растворяет: воспламеняет некоторые органические растворители (спирт, скипидар), однако в некоторых растворяется (четыреххлористый углерод, дихлорметан, сероуглегод). Подъедает металлы, но не настолько хорошо, как кислоты — опять дело в пассивации. например, сталь при воздействии приобретает красивую тёмно-синию поверхность.
Кожу — понятно — изъязвляет, при чём в этом сильнее хромпика, поскольку лучше проникает в кожу как в неполярную органическую ткань. Но дело даже не в этом, а в шестивалентном хроме, который вообще-то канцероген, а потому глубже проникнет — больше проблем. Ну и конечно надышаться куда опаснее.
Соляная кислота
HCl
Выше 38% в воде не бывает. Одна из самых популярных кислот для растворения — в этом она покруче остальных, потому что технологически может быть очень чистой, а кроме действия, как кислота, ещё и образует комплексные хлориды, которые повышают растворимость. Кстати, именно по этой причине нерастворимый хлорид серебра очень даже растворим в концентрированной соляной кислоте.
Эта при попадании на кожу жжётся чуток сильнее, субъективно — ещё и зудит, к тому же воняет: если в лаборатории с плохой вытяжкой работать много с концентрированной соляной кислотой — твой стоматолог скажет тебе «спасибо»: ты его озолотишь на пломбах. Кстати, помогает жвачка. Но не сильно. Лучше — вытяжка.
Поскольку не маслянистая и с водой сильно не разогревается, то едкость — только к металлам, и то не ко всем. Кстати, сталь в концентрированной соляной кислоте пассивируется и говорит ей «не-а!». Чем и пользуются при транспортировке.
Азотная кислота
HNO3
Тоже очень популярная, её тоже почему-то боятся — а зря. Концентрированная — это которая до 70% — она самая популярная, выше — это «дымящая», чаще всего никому не нужная. Есть ещё безводная — так та ещё и взрывается.
Будучи окислителем, пассивирует многие металлы, которые покрываются нерастворимой плёнкой и говорят: «до свидания» — это хром, железо, алюминий, кобальт, никель и другие.
С кожей моментально реагирует по принципу ксантопротеиновой реакции — будет жёлтое пятно, что означает, что ты, %username%, всё-таки состоишь из белка! Через какое-то время жёлтая кожа слезет, как при ожоге. При этом щиплет меньше соляной, хотя воняет не хуже — и на этот раз токсичнее: летящие окислы азота не очень хороши для организма.
В химии используют так называемую «нитрующую смесь» — самая популярная состоит из серной и азотной кислот. Используется в синтезах, в частности в получении весёлого вещества — пироксилина. По едкости — тот же хромпик плюс красивая жёлтая кожа.
Так же есть «царская водка» — это часть азотной кислоты на три части соляной. Используется для растворения некоторых металлов, в основном — драгоценных. На разном соотношении и добавлении воды основан капельный метод проверки пробы золотых изделий — кстати, специалистов по этому методу очень сложно надурить с подделкой. По едкости для кожи — та же «нитрующая смесь» плюс воняет отменно, запах не спутаешь ни с чем, он тоже довольно токсичный.
Есть ещё «обратная царская водка» — когда соотношение наоборот, но это редкая специфика.
Кстати, о той самой «дымящей», которая красная, злая и окислитель — цитирую рассказ хорошего друга, который мне вот прямо сейчас прислал.
Гнал я эту самую 98% азотку. То ли просто перегонял для очистки, то ли из меланжа, уже не помню. Нагнал литра два, снимаю приемник. Прошу лаборантку дать чистую колбу на 2 литра — перелить. Она мне и дала сухую, чистую, но из под спирта — и с закрытой пробкой. То есть пары были и накопились. Я туда воронку и переливаю. Я ее туда — а она обратно. Хорошо брызнула на руки, на рожу и ниже шеи. Ощущение — как орел в морду вцепился. Плюс руки, шея, под носом ну и т.д. по мелочи. В руках, напоминаю, два литра того же добра. Глаза закрыты, естественно. Понимаю, что бросить колбу нельзя, будет сразу сильно хуже. Аккуратно ставлю колбу на резиновую подставку, перемещаюсь к мойке, разворачиваю гусак себе в морду и включаю полный напор. Секунд за пять управился. До подкожной клетчатки не добралась. А то все было бы намного хуже. Видел у другого мужика, что бывает через 10-15 сек. Труднозаживающие багровые рубцы на половину руки. Потом понял, почему она такая злая. Мало того, что довольно сильная кислота и окислитель, она еще и чудесный растворитель. Неограниченно смешивается с водой, но неограниченно смешивается и с, например, дихлорэтаном. Такая себе бифильная дрянь.
Фосфорная кислота
H3PO4
На самом деле я привёл формулу ортофосфорной кислоты — самой распространённой. А есть ещё метафосфорная, полифосфорные, ультрафосфорные — короче, хватает, но неважно.
Концентрированная ортофосфорная кислота (85%) — это такой сиропчик. Кислота она сама по себе средняя, её часто используют в пищевой промышленности, кстати — когда тебе ставят пломбы, то поверхность зуба предварительно протравливают фосфорной кислотой.
Коррозионность у неё так себе, но есть неприятный нюанс: этот сиропчик хорошо впитывается. Поэтому если капнет на вещи — впитается, а потом будет потихоньку разъедать. И если от азотной и соляной кислоты будет пятно или дырка — то от фосфорной вещь будет разлазиться, особенно это красочно на обуви, когда дырка как бы крошится, пока не получится насквозь.
Ну а вообще едкой её назвать сложно.
Плавиковая кислота
HF
Концентрированная плавиковая кислота — это примерно 38%, хотя и бывают странные исключения.
Слабенькая кислота, которая берёт яростной любовью фторид-ионов образовывать стойкие комплексы со всем, с кем можно. Поэтому на удивление растворяет то, что другие, более сильные подруги — не могут, а потому очень часто используется в разных смесях для растворения. При попадании на руку ощущения будут больше от других компонентов таких смесей, но есть нюанс.
Плавиковая кислота растворяет SiO2. То есть песок. То есть стекло. То есть кварц. Ну и так далее. Нет, если ты плеснёшь на окно этой кислотой — оно не растворится, но мутное пятно останется. Чтобы растворить — нужно долго держать, а ещё лучше — нагреть. При растворении выделяется SiF4, который так полезен для здоровья, что лучше это делать под вытяжкой.
Маленький, но приятный нюанс: кремний содержится у тебя, %username%, в ногтях. Так вот, если плавиковая кислота попадёт под ногти — ты ничего не заметишь. Но ночью спать не сможешь — болеть будет ТАК, что иногда возникает желание оторвать палец. Поверь, друг — я знаю.
И вообще плавиковая кислота токсична, канцерогенна, впитывается через кожу и масса всего — но мы-то сегодня про едкость, правда?
Помнишь, мы договаривались в самом начале, что фтора не будет? Его и не будет. Но будут…
Фториды инертных газов
На самом деле фтор — суровый парень, с ним особо не повыпендриваешься, а потому некоторые инертные газы образуют с ним фториды. Известны такие стабильные фториды: KrF
2, XeF
2, XeF
4, XeF
6. Всё это — кристаллы, которые на воздухе с разной скоростью и охотой разлагаются влагой до плавиковой кислоты. Едкость — соответствующая.
Иодоводородная кислота
HI
Самая сильная (по степени диссоциации в воде) бинарная кислота. Сильный восстановитель, чем пользуются химики-органики. На воздухе окисляется и становится бурой, чем и пачкает при контакте. Ощущения при контакте — как от соляной. Всё.
Хлорная кислота
HClO4
Одна из самых сильных (по степени диссоциации в воде) кислот вообще (с ней конкурируют суперкислоты — о них ниже) — функция кислотности Гаммета (численное выражение способности среды быть донором протонов по отношению к произвольному основанию, чем меньше — тем сильнее кислота) составляет -13. Безводная — сильный окислитель, любит взрываться, да и вообще неустойчива. Концентрированная (70%-72%) — окислитель не хуже, часто используют в разложении биологических объектов. Разложение интересно и захватывающе тем, что может взрываться в процессе: нужно следить, чтобы не было частиц угля, чтобы не кипело слишком бурно и т.д. Хлорная кислота к тому же довольно грязная — её невозможно очистить субперегонкой, взрывается зараза! Поэтому используют её нечасто.
При попадании на кожу жжётся, ощущения как от соляной. Воняет. Когда видите в фильмах, что кто-то кинул труп в ёмкость с хлорной кислотой — и он растворился, то да, такое возможно — но долго или греть. Если греть — может рвануть (см. выше). Так что будьте критичны к кинематографу (я, кажется, видел это в «Кловерфилд, 10»).
Кстати, едкость оксида хлора (VII) Cl2O7 и оксида хлора (VI) Cl2O6 — это итог того, что с водой эти оксиды образуют хлорную кислоту.
А теперь представим, что мы решили в одном соединении объединить сильную кислотность — и едкость фтора: возьмём молекулу хлорной или серной кислоты — и заменим на ней все гидроксильные группы на фтор! Дрянь получится редкостная: она будет взаимодействовать с водой и подобными соединениями — и будет в месте реакции сразу получаться сильная кислота и плавиковая кислота. А?
Фториды серы, брома и иода
Помните, мы договорились рассматривать только жидкости? По этой причине в нашу статью не попал
трифторид хлора ClF3, который кипит при +12 °C, хотя все страшилки о том, что он жутко токсичен, воспламеняет стекло, противогаз и при разливании 900 килограммов — проедает 30 см бетона и метр гравия — всё это правда. Но мы же договорились — жидкости.
Однако есть жёлтая жидкость — пентафторид иода IF5, бесцветная жидкость — трифторид брома BrF3, светло-жёлтая — пентафторид брома BrF5, которые не хуже. BrF5, к примеру, тоже растворяет стекло, металлы и бетон.
Аналогично — среди всех фторидов серы жидким является только декафторид дисеры (иногда её называют ещё пятифтористой серой) — бесцветная жидкость с формулой S2F10. Но это соединение при обычных температурах достаточно стабильно, не разлагается водой — а потому не особо и едко. Правда, в 4 раза токсичнее фосгена с аналогичным механизмом действия.
Кстати, говорят, что пентафторид иода был «специальным газом» для заполнения атмосферы в спасательном шаттле в последних кадрах фильма «Чужой» 1979 года. Ну не помню, честно. Напомнился! Блин, там настолько круто, что я не удержался — и посвятил этому отдельную статью.

Суперкислоты
Термин «суперкислота» введён Джеймсом Конантом в 1927 году для классификации более сильных кислот, чем обычные минеральные кислоты. В некоторых источниках хлорную кислоту относят к суперкислоте, хотя это не так — она обычная минеральная.
Ряд суперкислот — это минеральные, к которым подцепили галоген: галоген тянет на себя электроны, все атомы очень сильно гневаются, а достаётся всё как обычно водороду: тот отваливается в виде Н+ — бабах: вот и кислота стала сильнее.
Примеры - фторсерная и хлорсерная кислотыУ фторсерной кислоты функция Гаммета -15,1, кстати, благодаря фтору, эта кислота постепенно растворяет пробирку, в которой хранится.
Потом кто-то из умных подумал: а давайте возьмём кислоту Льюиса (вещество, способное принять пару электронов другого вещества) и смешаем с кислотой Бренстеда (веществом, которое способно отдавать протон)! Смешали пентафторид сурьмы с плавиковой кислотой — получили гексафторсурьмяную кислоту HSbF6. В этой системе плавиковая кислота выделяет протон (H+), а сопряжённое основание (F−) изолируется координационной связью с пентафторидом сурьмы. Так образуется большой октаэдрический анион (SbF6−), являющийся очень слабым нуклеофилом и очень слабым основанием. Став «свободным», протон обусловливает сверхкислотность системы — функция Гаммета -28!
А потом пришли другие и сказали, а чего это кислоту Бернстеда взяли слабую — и придумали вот что.
Трифторметансульфоновая кислота— сама по себе уже суперкислота (функция Гаммета -14,1). Так вот, к ней добавили опять пентафторид сурьмы — получили снижение до -16,8! Такой же фокус с фторсерной кислотой дал снижение до -23.
А потом группа ученых с химической кафедры американского университета Калифорнии под управлением профессора Кристофера Рида затусила с коллегами из Института катализа СО РАН (Новосибирск) и придумали карборановую кислоту H(CHB11Cl11). Ну «карборановой» её назвали для обычных людей, а если хочешь почувствовать себя учёным — произнеси «2,3,4,5,6,7,8,9,10,11,12-ундекахлор-1-карба-клозо-додекаборан(12)» три раза и быстро.
Так выглядит эта красоткаЭто — сухой порошочек, который растворим в воде. Это и есть Самая Сильная Кислота на текущий момент. Карборановая кислота приблизительно в миллион раз сильнее концентрированной серной кислоты. В обычных шкалах измерить силу кислоты не удается, так как кислота протонирует все известные слабые основания и все растворители, в которых она растворяется, включая воду, бензол, фуллерен-60, диоксид серы.
Впоследствии Кристофер Рид в интервью службе новостей Nature сказал: «Идея синтеза карборановой кислоты родилась из фантазий «о молекулах, никогда прежде не создаваемых». Вместе с коллегами он хочет использовать карборановую кислоту для окисления атомов инертного газа ксенона — просто потому, что никто прежде этого не делал. Оригинально, что сказать.
Ну поскольку суперкислоты — это обычные кислоты, то и действуют они обычно, только немного сильнее. Ясно, что кожу будут жечь, но это не значит — что растворять. Фторсульфоновая — отдельный случай, но там всё благодаря фтору, как и в плавиковой.
Тригалогенуксусные кислоты
А конкретно - трифторуксусная и трихлоруксусная кислота
Милы и приятны сочетанием свойств органического полярного растворителя и достаточно сильной кислоты. Воняют — похоже на уксус.
Самая няшка — трифторуксусная кислота: 20%-ный раствор разрушает металлы, пробку, резину, бакелит, полиэтилен. На коже жжётся и образует сухие язвы, доходящие до мышечного слоя.
Трихлоруксусная в этом плане — младший брат, но тоже ничего. Кстати, аплодисменты слабому полу: в погоне за красотой, некоторые идут на так называемую процедуру ТСА-пилинга (ТСА — это TetraChloroAcetate) — когда этой самой трихлоруксусной кислотой растворяют верхний огрубевший слой кожи.
Уксусная кислота
СН3СООН
Скорее всего, у тебя на кухне есть эта кислота — и да, она используется как пищевая добавка Е260. Но также она бывает и покрепче — 70-80%-й водный раствор уксусной кислоты называют уксусной эссенцией, а если концентрация близка к 100% — ледяной уксусной кислотой (потому что она может замерзать и образовывать нечто похожее на лёд.
Уксусная кислота не так едка по отношению к металлам, как минеральные кислоты, но поскольку и не так полярна, а в какой-то степени даже дифильна (сочетание гидрофобной и гидрофильной части в одной молекуле — как в поверхностно-активных веществах) — то она здорово всасывается кожей. Опасными считаются растворы с концентрацией уксусной кислоты больше 30%. Особенность ожогов в том, что также инициируется развитие коагуляционных некрозов прилегающих тканей различной протяженности и глубины — если не смыть, то будут долго заживающие язвы и рубцы.
Ну и воняет она, конечно, знатно.
Муравьиная кислота
НСООН
Мы уже обсуждали,
что муравьиная кислота, образующаяся в организме после принятия метанола, — одна из основных причин его токсичности. Так вот, муравьиная кислота извне вовсе не так опасна, поскольку быстро метаболизируется и выводится организмом. Токсичность довольно низка — для крыс LD
50порядка 1,8 г/кг, а потому муравьиную кислоту тоже часто используют, в том числе и как пищевую добавку — и этого бояться не стоит.
»Едкость" муравьиной кислоты зависит от концентрации. Согласно классификации Европейского союза, концентрация до 10% обладает раздражающим эффектом, больше 10% — разъедающим. И речь опять не о металлах и стекле — а об организме. При контакте с кожей 100%-я жидкая муравьиная кислота вызывает сильные химические ожоги. Попадание даже небольшого её количества на кожу причиняет сильную боль, поражённый участок сначала белеет, как бы покрываясь инеем, потом становится похожим на воск, вокруг него появляется красная кайма. Кислота легко проникает через жировой слой кожи, поэтому промывание поражённого участка раствором соды необходимо произвести немедленно. Так что муравьи действительно что-то знают.
Бром
Br2
Тяжёлая едкая жидкость красно-бурого цвета с сильным неприятным запахом, отдалённо напоминающим запах одновременно иода и хлора. Кстати, название «бром» от греческого βρῶμος — «вонючка», «вонючий».
Бром — типичный галоген, по химической активности бром занимает промежуточное положение между хлором и иодом. То есть не такой прыткий, как фтор — но поживее скучного иода. И да, до хлора тоже не дотягивает.
Немного растворим в воде, хорошо — в некоторых органических растворителях. Бромная вода — реактив на непредельные углеводороды — воняет, но вполне себе мирная и ничего сильно не растворяет.
Чистый бром могуч, вонюч и волосат, а также токсичен. При попадании на кожу вызывает ожоги: неприятность в том, что молекулы брома неполярны, а потому хорошо проникают в гидрофобную человеческую кожу и плоть — а потому ожоги действительно болезненны, долго заживают, почти всегда оставляют на память шрам. Алюминий вспыхивает при контакте с бромом, остальные металлы более воздержаны, но в виде порошка — некоторые реагируют, например, железо.
Бетон и стекло к брому достаточно устойчивы. Органические соединения бромом — что? — правильно! — бромируются при наличии ненасыщенной связи. По этой причине устойчивость полимеров зависит от их типа, к примеру полиэтилен и полипропилен — плевать хотели на бром при комнатных условиях.
Пероксид водорода
H2O2
Нестабильное соединение, которое постоянно постепенно разваливается на кислород и воду. Чем выше концентрация — тем нестабильнее, что постепенно превращается во взрывоопасность. Для стабилизации технического пероксида водорода в него добавляют пирофосфат или станнат натрия; при хранении в алюминиевых емкостях используют ингибитор коррозии — нитрат аммония.
Пероксид водорода в лаборатории обычно представляет собой раствор 38%. При попадании на кожу оказывает химический ожог с характерным белым окрашиванием. Ожог болезненный, особенно на тонкой коже, побелевшая ороговевшая кожа потом часто трескается и зудит.
В медицине используют 3% пероксид водорода для очистки глубоких ран сложного профиля, гнойных затёков, флегмон и других гнойных ран, санация которых затруднена — так вещество обладает не только антисептическим эффектом, но и создаёт большое количество пены при взаимодействии с ферментом каталазой. Это в свою очередь позволяет размягчить и отделить от тканей некротизированные участки, сгустки крови, гноя, которые будут легко смыты последующим введением в полость раны антисептического раствора. Кстати, перекись водорода нежелательна в других случаях ран: обладая хорошими очищающими свойствами, это вещество на самом деле не ускоряет процесс заживления, поскольку повреждает прилегающие к ране клетки, равно как и молодые, новообразующиеся ткани — а это ещё и чревато образованием рубцов.
Кроме как ожогов на коже — ничего не разъедает и не растворяет. Металлы, стекло и пластики устойчивы к пероксиду водорода.
А ещё пероксид водорода подарил миру много уникальных натуральных блондинок с чёрными корнями волос!
Близки к пероксиду водорода так называемые надкислоты — кислоты, в которых присутствуют пероксидные группы. Пример: надуксусная кислота СН3СОООН — вещество, напоминающее по свойствам пероксид водорода, а потому и использующееся точно в таких же сферах. Есть «первомур» или «С-4» (нет, это не тот С-4, о котором ты подумал) — это пермуравьиная кислота HCOOOН, которая ещё слабее надуксусной, а потому хирируги моют ей руки перед операцией. И наконец — трифторперуксусная кислота СF3СОООН — лютый, бешеный окислитель, на который с восхищением смотрят химики-органики за возможность окисления анилина до нитробензола, получения гипервалентного иода в органических соединениях, реакцию Байера-Виллигера и другие малопонятные нормальным людям вещи. По едкости — трифторуксусная кислота, смешанная с перекисью водорода, чем, собственно, и является, а потому для рук представляет особую опасность, да. В виду своей высокой окислительной способности, трифторперуксусная кислота не продаётся, а обычно получается восхищающимися химиками-органиками прямо там, где необходимо, взаимодействием трифторуксусного ангидрида с пероксидом водорода.
Ну вот примерно так, если говорить про жидкость и про едкость. Будут ещё дополнения?
5 правил ухода за электрическим чайником
Июнь 08
Электрический чайник на современной кухне - незаменимый помощник. Как ухаживать за электроприбором, чтобы продлить ему жизнь и поддержать чистоту?1. Избавляемся от накипи.
В любой питьевой воде содержатся разнообразные соли, которые необходимы для нашего организма, но вредоносны для чайника. Каким бы хорошим не был фильтр или какой бы качественной не была бутилированная вода, рано или поздно на донышке и стенках чайника образуется белый налет. Чтобы не обнаружить у себя в чашке неприятный осадок, похожий на песок, следует проводить своевременную очистку.
Чистку можно провести как специальными средствами, так и сподручными, такими как лимонная кислота или уксус.
Стоит наполнить чайник водой, налить две или три столовые ложки уксусной кислоты (в той же пропорции можно использовать порошок лимонной кислоты), вскипятить чайник и оставить его остывать на ночь. Утром необходимо будет слить воду вместе с растворившимся осадком и промыть чайник проточной водой.
Такая процедура позволит не только сохранить нагревательный элемент, но и сохранить эффективность прибора на протяжении всего срока эксплуатации. Толстый слой накипи на дне чайника, под которым скрыт нагревательный элемент, может привести к неправильному срабатыванию термостата и отключению чайника до закипания или к длительному кипячению.
2. Содержим корпус и подставку чайника в чистоте.
Все поверхности на кухне подвержены загрязнению, во время уборки не стоит забывать и о чайнике. Корпус можно очищать любыми неабразивными средствами, например, жидкостью для мытья посуды. Однако, мокрый чайник нельзя ставить на подставку и сразу включать, вытрите его кухонным полотенцем или дайте полностью высохнуть перед использованием.
3. Выливаем всю воду из чайника.
Мы предлагаем Вам придерживаться следующей стратегии при использовании чайника: наливайте в чайник ровно столько воды, сколько кипятка планируете использовать. Во-первых, таким образом можно избежать повторного кипячения воды, которое приводит к образованию большего количества накипи. Во-вторых, чайник лучше оставлять пустым в перерывах между работой, а кипяченую воду хранить в кувшине.
4. Не включаем пустой чайник.
Несмотря на то, что большинство современных чайников оборудовано термостатом для защиты от перегрева, все же пред включением следует убедиться, что уровень воды полностью покрывает нагревательный элемент.
5. Не наливаем воду выше максимальной отметки.
Ограничение количества воды в приборе связано прежде всего с безопасностью: избыток воды может выплескиваться из носика при закипании, что может привести к ожогам или короткому замыканию. По этим же соображениям, чайник стоит размещать только на ровной горизонтальной поверхности.
Соблюдая эти простые правила, можно значительно продлить жизнь любимого электрического чайника VEKTA.
Можно ли вылить муратовую кислоту в канализацию? (2021)
Связанные вопросы
- Можно ли смыть соляную кислоту в унитаз?
- Стареет ли мурат кислота?
- Можно ли заливать мочевую кислоту в распылитель?
- Можно ли вылить кислоту в канализацию?
- Безопасно ли сливать мочевую кислоту в канализацию?
- Что произойдет, если вы добавите в бассейн слишком много мочевой кислоты?
- Могу ли я добавить муратную кислоту прямо в бассейн?
- Можно ли налить в кастрюлю соляную кислоту?
- Когда следует нейтрализовать химическое вещество перед сбросом в канализацию?
- Можно ли слить соляную кислоту в канализацию?
Можно ли смыть соляную кислоту в унитаз?
Зорайр Дата создания: 26.11.2021
Смешайте одну часть соляной кислоты с пятью частями воды и медленно вылейте этот раствор в унитаз.Добавьте достаточно воды, чтобы довести уровень воды в миске до нормального. Если вы добавите еще один, он потечет по дренажной линии в сторону септика. Оставьте кислотный раствор в миске на два-три часа.
Уильям Робертсон Дата создания: 26.11.2021
Стареет ли мурат кислота?
все больше и больше Дата создания: 26.11.2021
Бисульфат натрия и соляная кислота могут иметь срок годности 5 лет, однако веществами, снижающими pH, являются кислоты, и более серьезной проблемой при понижении pH является прочность контейнера.... Итак, хотя химикаты pH-Down служат годами, вам, вероятно, стоит их использовать.
Арсений-II Дата создания: 28.11.2021
Можно ли заливать мочевую кислоту в распылитель?
Даррен Копп Дата создания: 08.12.2021
Марриновую кислоту следует смешивать только в стеклянной или кислотостойкой пластиковой таре (список можно найти здесь).... При использовании соляной кислоты на больших поверхностях ее следует наносить пластиковым распылителем. Пластик быстро сломается, поэтому для выполнения работы вам, скорее всего, понадобится больше одного.
Гулам Хуссейн Дата создания: 10.12.2021
Можно ли вылить кислоту в канализацию?
Альберт Дата создания: 26.11.2021
безопасно использовать с пластиковыми трубками.Серная кислота очень проста в использовании и разблокирует слив в течение часа, обычно в течение нескольких секунд, если он не забит полностью. Серная кислота возникает в естественных условиях и безопасна для сточных вод и септиков, поскольку она разбавляется при прохождении по трубам.
Мухаммед Мусса Дата создания: 29.11.2021
Можно ли слить мочевую кислоту в канализацию?
Аминадав Гликштейн Дата создания: 27.11.2021
В домашних условиях никогда не используйте соляную кислоту, не разбавив раствор водой.Это вещество очень едкое, и если его нанести непосредственно в канализацию, ваши трубы могут быть серьезно повреждены. ... К тому времени соляная кислота должна очистить закупорку, и сток будет чистым.
Лоло Тостер Дата создания: 28.11.2021
Что произойдет, если вы добавите в бассейн слишком много мочевой кислоты?
rmaddy Дата создания: 29.11.2021
Если добавить слишком много соляной кислоты, уровень pH может упасть до опасно низкого уровня, а вода в бассейне может вызвать сыпь и раздражение глаз.Низкий уровень pH также может повредить металлы бассейна, такие как лестницы, перила, винты, болты и другое важное оборудование.
WaLid LamRaoui Дата создания: 01.12.2021
Могу ли я добавить муратную кислоту прямо в бассейн?
Энгью больше не гордится SO Дата создания: 02.12.2021
Добавьте соляную кислоту Если вы спешите, вы можете налить соляную кислоту прямо в воду в бассейне, но сначала разбавив соляную кислоту, с ней будет легче работать, и она станет менее опасной в случае разбрызгивания.Это стоит лишних нескольких минут и ведра для полива. Идеальное соотношение воды и соляной кислоты - 10: 1.
Даггетт Дата создания: 02.12.2021
Можно ли налить в кастрюлю соляную кислоту?
Аллан Кэмерон Дата создания: 29.11.2021
Если у вас есть бассейн на заднем дворе, соляная кислота может быть неотъемлемой частью поддержания правильного химического состава воды.Основная причина, по которой муратную кислоту следует добавлять в воду в бассейне, заключается в том, что она помогает снизить уровень pH, который стал слишком высоким.
Сомнатх Мулук Дата создания: 02.12.2021
Когда следует нейтрализовать химическое вещество перед сбросом в канализацию?
TheMaster Дата создания: 26.11.2021
Перечисленные материалы считаются относительно нетоксичными.Соединения любого из этих ионов, которые являются сильнокислыми или основными, должны быть нейтрализованы перед сбросом в канализацию. Перед утилизацией минеральные кислоты и основания необходимо нейтрализовать до pH в диапазоне от 5,5 до 9 в соответствии с процедурами, приведенными в Приложении A.
user1032613 Дата создания: 26.11.2021
Можно ли слить соляную кислоту в канализацию?
жених Дата создания: 24.11.2021
Кислота может разрушить бактериальный процесс в септической системе и дренажной системе.Никогда не бросайте соляную кислоту или другие кислоты или щелочи на землю, в канализацию дождевой воды или желоб, так как они могут загрязнить грунтовые воды, поверхностные воды и питьевую воду.
Йооп Эгген Дата создания: 24.11.2021
.начальная школа Иоанн Павел II в Конарах
Опыт. «Заливка» углекислого газа.
 Реактивы: уксус, сода пищевая
Реактивы: уксус, сода пищевая
Материалы: свеча, пластилин, шар
Оборудование: 2 стакана, стеклянная бутылка
Версия: На дно пустого стакана прикрепите пластилиновую свечу и зажгите ее.Налейте в бутылку небольшое количество уксуса, добавьте в баллон 1 чайную ложку пищевой соды, наденьте баллон на бутылку, влейте соду в уксус. Второй стакан, наполненный углекислым газом, собранным в баллоне, наклоняют над стаканом с зажженной свечой. Сделайте наблюдение.
Наблюдения: после «заливки» углекислого газа в стакан со свечой , свеча быстро гаснет
Вывод: углекислый газ тяжелее воздуха и тонет в стакане со свечой

Опыт "Крепкий чай"
 Реагенты : сода, уксус или лимонная кислота
Реагенты : сода, уксус или лимонная кислота
Лабораторный стакан : 3 стакана
Тип .
Заварить около 200см 3 чая. Налейте одинаковое количество чая в каждый из 3 стаканов. В первую добавить половину чайной ложки лимонной кислоты или столовую ложку уксуса, вторую оставить для сравнения, в третью добавить половину чайной ложки пищевой соды. Внимательно следите за цветом раствора. Вылейте содержимое 3 стаканов в стакан 1.
Наблюдения Цвет в первом стакане меняется на янтарный - характерный для некрепкого чая, а в третьем стакане - на темно-коричневый - характерный для очень крепкого настоя.После переливания содержимого стакана 3 в стакан 1 начинается довольно бурная реакция, видны пузырьки выделяющегося газа.
Выводы Производные танина, содержащиеся в чае, меняют цвет под действием pH. Добавление NaHCO 3 соды, которая легко гидролизуется, поскольку представляет собой соль слабой кислоты и сильного основания, увеличивает концентрацию гидроксид-ионов (OH -) в растворе и, таким образом, увеличивает pH (щелочной реакция). Добавление лимонной или уксусной кислоты, которая за счет диссоциации увеличивает концентрацию ионов водорода (H + ) в растворе, снижает pH (кислая реакция).
После переливания содержимого 3-го стакана в 1-й начинается довольно бурная реакция разложения карбонат-анионов. В результате выделяется углекислый газ, наличие которого можно проверить, подойдя к горящему факелу, который гаснет в присутствии углекислого газа.

Опыт "Тайное письмо"
 Для стажа вам понадобится:
Для стажа вам понадобится:
- игла (также может быть пером или палкой)
- Сок лимонный выжатый
- лист
- Горелка для спирта
Тип
Пропускаем иглу в лимонном соке и делаем на листе загадочную надпись.Ждем высыхания. Зажигаем спиртовку и начинаем интенсивно нагревать лист, стараясь не загореться
Наблюдения . Через некоторое время в сильно нагретых местах стали появляться очертания букв. Вскоре скрытый контент отображается коричневыми буквами
.
Выводы. Надпись сделана из органических веществ, содержащихся в лимонном соке, которые разлагаются под действием высокой температуры.Эти чернила являются такими чернилами, которые раскрывают содержание записи только посвященным, которые знают, какими действиями они могут прочитать написанное с их помощью. Лимонный сок может быть такой краской, поскольку он безопасен и легко доступен
Опыт. Разделение компонентов цветных чернил (хроматография) 9000 5
 Модель. Налейте уксус в мерный цилиндр 100 см 3 прим.1 см. Затем отрежьте полоску фильтровальной бумаги размером 2 × 24 см. На одном конце полоски на расстоянии 2 см от низа цветным пером (например, коричневым) проведите горизонтальную линию. Другой конец полоски загните примерно на 2 см от конца и прикрепите к стеклянному стержню. Вставьте промокательную бумагу в цилиндр так, чтобы его конец, на котором вы нарисовали линию, был погружен в жидкость на глубину примерно 1 см.
Модель. Налейте уксус в мерный цилиндр 100 см 3 прим.1 см. Затем отрежьте полоску фильтровальной бумаги размером 2 × 24 см. На одном конце полоски на расстоянии 2 см от низа цветным пером (например, коричневым) проведите горизонтальную линию. Другой конец полоски загните примерно на 2 см от конца и прикрепите к стеклянному стержню. Вставьте промокательную бумагу в цилиндр так, чтобы его конец, на котором вы нарисовали линию, был погружен в жидкость на глубину примерно 1 см.
Наблюдения: Жидкость движется вверх через бумажную полоску, разделяя разноцветные компоненты чернил
Выводы: Чернила в ручке представляют собой смесь нескольких цветных веществ.Разделение компонентов происходило в результате их разной «адгезии» к бумаге и, как следствие, разной скорости их движения в бумаге.
90 200
90 202Опыт. Отличите кислоты от оснований стрелками.
Исполнение. Наполните 4 мензурки последовательно лимонадом, водопроводной водой с чайной ложкой пищевой соды и уксусом, а в четвертый - простой водой.Добавьте отвар краснокочанной капусты в каждый стакан.
Наблюдения : лимонад меняет цвет отвара краснокочанной капусты на розовый, пищевая сода меняет цвет отвара краснокочанной капусты на синий, в то время как в стакане № 4 цвет не меняется, т.е. остается фиолетовым.
Выводы : Отвар краснокочанной капусты является индикатором, потому что в зависимости от окружающей среды он меняет свой цвет, в присутствии кислот он становится красным, а в присутствии оснований - синим.В природе есть много веществ, которые могут служить индикаторами, например, свекольный сок, чайная эссенция.
Опыт "Локомотив"
 Реактивы:
Реактивы:
Пергидроль - водный раствор перекиси водорода (концентрация 30%) 9000 5
Перманганат калия (VII) - кристаллы, порошок или пыль
Стакан лабораторный:
Колба коническая, стакан
Версия: Залить ок.15 мл пергидрола, добавьте внутрь несколько кристаллов перманганата калия (VII), затем сразу отойдите.
Наблюдения. Начинается бурная и бурная реакция, во время которой раствор интенсивно нагревается, что вызывает кипение воды, которая в виде водяного пара, смешанного с кислородом, выходит через горловину колбы.
Выводы. Реакция полностью разлагает перманганат и затем катализируется исключительно оксидом марганца (IV).После реакции в сосуд оставляют горячую суспензию MnO 2 в водном растворе КОН.
Опыт. Проверка свойств йода
 Реагент: кристаллов йода
Реагент: кристаллов йода
Стекло и лабораторное оборудование: колба круглодонная, стакан, горелка, тренога
Реализация: В стакан налить йод, поставить на него круглодонную колбу с холодной водой и нагреть.
Наблюдения : Йод не плавится при нагревании, а сразу образует темно-пурпурные пары, через некоторое время со дна колбы можно увидеть кристаллический йод.
Заключение : Здесь происходит явление сублимации, а затем пары йода при контакте с холодной поверхностью колбы снова превращаются в твердый кристаллический йод. Это повторная сублимация.

Опыт. Тест серебряного зеркала - тест Толленса
90 370 Стекло и лабораторное оборудование: пробирки, водяная баня, горелка
Реактивы: глюкоза, AgNO 3, NaOH, 25% раствор NH 3
Процедура: Налейте 3 см раствора нитрата серебра (V) 3 в пробирку, добавьте по кружку капель концентрированного раствора гидроксида натрия, а затем по каплям добавьте раствор аммиака до растворения осадка.В полученный раствор влить раствор глюкозы и нагреть пробирку на водяной бане (в стакане с горячей водой).
Наблюдения: При нагревании содержимого пробирки на ее стенках выделяется серебро.
Выводы: Глюкоза, подвергнутая тесту Толленса, дает положительный результат, потому что слой серебряного зеркала появляется на стенках пробирки под воздействием нагрева.7 Глюкоза обладает восстанавливающими свойствами.
Реакция создания серебряного зеркала может быть представлена следующими уравнениями:
AgNO 3 + NaOH => AgOH + NaNO 3
2AgOH => Ag 2 O + H 2 O
Ag 2 O + глюкоза => 2Ag +
глюконовая кислота 90 202Опыт.Сколько воздуха могут удерживать ваши легкие?
Необходимые предметы и вещества: бутылка, завинчивающаяся крышка, стеклянный сосуд, трубочка для питья
Исполнение.
90 466Что происходит?
Вверху бутылки формируется заготовка.Показывает, сколько воздуха вы втянули в легкие за один вдох
90 478Опыт. «Бумага расплавленная»
 Модель. Скомните бумагу и прижмите ее ко дну стакана. Опустите стакан вертикально (вверх дном) на дно тиски с водой. Что не так с бумагой? Где уровень воды в стакане? Вода может попасть в стакан, сжимая в нем воздух, невозможно сжать воздух настолько, чтобы вода попала на бумагу.Воздух оказывает давление в противоположном направлении и препятствует попаданию воды на бумагу. Поэтому бумага остается сухой.
Модель. Скомните бумагу и прижмите ее ко дну стакана. Опустите стакан вертикально (вверх дном) на дно тиски с водой. Что не так с бумагой? Где уровень воды в стакане? Вода может попасть в стакан, сжимая в нем воздух, невозможно сжать воздух настолько, чтобы вода попала на бумагу.Воздух оказывает давление в противоположном направлении и препятствует попаданию воды на бумагу. Поэтому бумага остается сухой.
90 545
Опыт.«Звуковое путешествие»
90 555 Тип . Отрежьте дно пластиковой бутылки, затем вырежьте кусок полиэтиленового пакета, чтобы закрыть конец бутылки. Оберните кусок пластика ровно вокруг конца бутылки, закрепите скотчем. Зажечь свечу. Затем держите бутылку горлышком примерно в 2,5 см от свечи. Теперь резко «постучите» по фольге кончиками пальцев. Что с пламенем? Когда вы стучите по пластиковой пленке, вы заставляете крошечные частицы воздуха рядом с ней вибрировать.Эти вибрирующие частицы приводят в движение другие частицы, находящиеся поблизости. Вибрации проходят через бутылку и заставляют пламя
дрожать.90 560
БОЛЬШЕ В ФОТОАЛЬБОМЕ !!!
.90,000 новой алхимии: март 2015 г.Почему-то в школьной дидактике тема буферов как-то не связана с правилом противоречия, хотя их работа - лучший пример этого принципа. Кажется, что, поскольку это обычно обсуждается перед обсуждением законов газа и рассматривается вместе с законом действия масс в качестве введения к этому разделу, студенты узнают о действии правила на примере превращения оксида азота II из от мономолекулярной до димерной формы, или синтез аммиака из элементов.Затем, однако, он не возвращается в разделы, посвященные другим типам и средам реакции, в результате знания вместо накопления и синтеза разбиваются на отдельные блоки.
Так называемое правило противоречий (или, точнее, правило Ле Шателье-Брауна) - это довольно произвольное утверждение, что определенные системы, находящиеся в состоянии равновесия, реагируют на раздражители, нарушающие это равновесие, как если бы они сопротивлялись изменениям, стремясь уменьшить эффекты изменений. В этом смысле солевая система на дне сосуда обратным образом реагирует на добавление воды с ее насыщенным раствором - часть соли растворяется, и концентрация раствора не изменяется.Этот принцип можно обобщить и на другие области, так как он также применим к нехимическим системам, например, к социальным изменениям или экономическому равновесию.
Равновесие, в котором находятся системы, подпадающие под это правило, является динамическим равновесием, и это не означает, что в них нет никаких реакций, а то, что противоположные реакции происходят с одинаковой скоростью. Лучшей иллюстрацией здесь будет система соединенных сосудов, в которой уровень воды остается неизменным, но из-за хаотических движений частиц то и дело небольшие порции переходят от одного сосуда к другому.
Если мы поднимем один сосуд, вода потечет из него в нижний, пока он не уравновесится водой, которая отталкивается назад. Думаю, это понятно. Химическим эквивалентом этого может быть, например, равновесие между, например, водой, диоксидом углерода и угольной кислотой:
H 2 O + CO 2 ⇌ H 2 CO 3
Двуокись углерода реагирует с водой с образованием угольной кислоты, но в то же время угольная кислота разлагается на воду и двуокись углерода.В нормальных условиях равновесие сильно смещено влево, а это значит, что самой кислоты не много, и на самом деле она находится в форме ионов, так как ее молекула очень нестабильна. Если мы увеличим давление газа, тем самым увеличив концентрацию, ощущаемую раствором (то есть количество молекул, которые готовы реагировать в единицу времени), равновесие сместится вправо - часть газа растворится и давление упадет. . Если мы уменьшим давление или разбавим газ над раствором, например, азотом, часть угольной кислоты разрушится и немного компенсирует снижение концентрации.Вот в чем извращенность.
Буферный раствор, с другой стороны, устойчив к изменениям pH. Добавляя кислоту, мы не подкисляем ее до определенных пределов, добавляя основания, мы не делаем ее до некоторой степени щелочной. Чистый вызов! Однако причина их поведения парадоксальна - буферные растворы представляют собой смеси кислот и оснований.
Чтобы уточнить, нужно вернуться к такому основному пункту, как определения «кислоты» и «основания» - а это не очевидно. Первоначально вещества, имеющие кислотный вкус, назывались кислотами, а золы и обгоревшие металлы - щелочами.Позже была сделана попытка прояснить этот вопрос, заявив, что вещества, нейтрализующие кислоты, являются основаниями, что, однако, привело к тавтологии, поскольку, для разнообразия, «кислоты» определялись как нейтрализующие вещества.
Щелочь, а точнее щелочь, получали из золы выщелачиванием водой - отсюда и название от арабского «al kali» - «зола». Такой фильтрат, получивший название поташа, состоял в основном из карбонатов калия и соды с примесью гидроксидов. Только после реакции с гашеной известью (каустизация) были получены гидроксиды, которые при растворении в воде давали «едкий калий».
Чтобы не попасть в порочный круг, в 18 веке было принято общее определение кислот как летучих веществ, содержащих неметаллы, чьи растворы в высокой концентрации обладают едкими свойствами и растворяют металлы, в то время как основания были нелетучими веществами. , которые, вступая в реакцию с кислотами, устраняют их едкие свойства. Поэтому основания считались базовыми, которые удерживали летучие кислоты и давали нейтральные соли и другие соединения - это отчасти алхимическое утверждение в некоторой степени способствовало существующей номенклатуре.В английском, немецком, французском и многих других языках принцип - это «основа», и это слово почти всегда используется в нехимическом контексте как «основа» или «принцип действия».
Антуан Лавуазье, выдающийся химик того времени, уточнил определение, добавив, что кислоты содержат центральный атом с высокой степенью окисления, окруженный атомами кислорода, и образованы из оксидов неметаллов, а оксиды металлов образуют основания. Для серной или фосфорной кислот правило работает очень хорошо, к сожалению, оно подразумевает, что все кислоты должны быть кислородом.Авторитет французского химика был настолько велик, что, когда Шил открыл хлор, который производил сильно кислое вещество с чистым водородом, он считался оксидом неизвестного элемента, называемого мюрием. Поскольку кислород должен был быть элементом, характерным для кислот, когда дело дошло до присвоения ему научного названия, этот факт был подчеркнут, и сочетание латинского оксис - кислота - и gennao - дало название оксигений, которое наш Снядецкий пытался перевести , создавая польскую номенклатуру, как Kwasoród. К счастью, название не прижилось, потому что в 1810 году Хэмфри Дэви доказал, что соляная кислота, а также сероводород и селеновая кислота не содержат кислорода.

Лишь в 1838 году Юстус фон Либих, изучая органические кислоты, обнаружил, что кислоты характеризуются присутствием водорода, который легко отщепляется и может быть заменен атомом металла, содержащимся в основаниях. Водород также вытесняется из кислот в результате реакции с активными металлами, такими как железо и цинк. Поскольку активные металлы аналогичным образом реагируют с водой, которая, как известно, состоит из двух атомов водорода и одного атома кислорода, при повышенных температурах, после проверки масс можно было сделать вывод, что существует «причинный остаток» - Ионы ОН.Обладая этими знаниями, в 1884 году Сванте Аррениус сформулировал теорию, согласно которой кислоты - это вещества, выделяющие ионы водорода, растворенные в воде, а основания - это вещества, выделяющие ионы гидроксила. Таким образом, основания и кислоты включают как кислоты и гидроксиды, так и оксиды металлов и неметаллов.
Кислоты:
HCl = H + + Cl -
SO2 + h3O = 2H + + SO3-
Основания:
NaOH = Na + + OH-
MgO + h3O = Mg (OH) 2
К сожалению, свойства некоторых веществ нельзя объяснить таким образом.В основном аммиак, который после растворения не отдавался, а поглощал водород в воде, высвобождая гидроксильные ионы и вызывая щелочную реакцию. Существует также пример борной кислоты, которая, растворяясь в воде, удаляет из нее группу ОН, оставляя ионы водорода и делая раствор кислым. В качестве дополнения следует добавить, что де-факто свободные ионы водорода не наблюдаются - это были бы свободные протоны с довольно коротким временем жизни, - но они объединяются со следующей молекулой воды в ионы h4O +.
Чтобы немного восполнить эти недостатки, в 1923 году два исследователя Johannes Nicolaus Brønsted и Martin Lowry , совершенно независимо друг от друга, сформулировали другую теорию. Предполагалось, что кислоты - это те вещества, которые отдают протоны, а основания - те, которые их принимают. Ну, аммиак принимает водород, а его раствор щелочной - это основание. Гидроксиды связывают протоны кислот. Кислоты отдают протоны. Все правильно. Однако, поскольку не все подходит, были разработаны другие теории для объяснения поведения веществ в растворителях, отличных от воды и расплавленных солей, но я не буду касаться их.
И что из всего этого получается? Как я уже сказал, буферы - это смеси кислот и оснований. Но Бронстед. В растворе есть как донорные, так и протоноакцепторные вещества, как нейтрализующие кислоты, так и нейтрализующие основания. Представьте, что у нас есть два стакана меньшего размера, вставленные в стакан, в одном из которых находится кислота, например серная кислота, а в другом - основание, например гидроксид натрия, и предположим, что мы примем общий рН стакана как разницу между pH мензурки.Теперь давайте добавим немного кислоты в раствор с основанием - порция нейтрализуется, а избыток основания не приведет к значительному изменению pH раствора. Или иначе - давайте добавим немного основания в стакан для кислоты - порция станет нейтральной, а присутствующий избыток ... и т. Д.
Что ж, в конце концов, это был наш «результирующий pH», который немного изменился: в первом случае мы потеряли немного кислоты, а во втором - немного щелочи. Итак, теперь давайте представим, что мы меняем реакцию с помощью магического заклинания, чтобы уровни вернулись к начальным уровням, и все в порядке.Это наше магическое заклинание может быть здесь правилом неповиновения, но оно происходит в этих особых условиях, когда основание может превращаться в кислоту, а кислота - в основание.
\>
Как я уже писал ранее, согласно Бренстеду, кислота - это вещество, отдающее протоны. Когда протон отказывается, у нас остается кислотный остаток, но он также может принять протон и снова стать исходной молекулой. Поскольку он может принимать протон, это правило. Это даже вполне логично - при нейтрализации гидроксида натрия соляной кислотой образуется поваренная соль, т.е. хлорид натрия, при добавлении в его раствор сильной кислоты, например серной кислоты, равновесие реакции нейтрализации - пока полностью сдвинут вправо - частично повернет вспять и начнет отделять газообразный хлороводород.В прошлом именно так производили соляную кислоту, откуда и произошло название.
Таким образом, соляная кислота представляет собой кислоту, а образующийся хлорид-анион является основанием. Однако раствор соляной кислоты и хлорида натрия не является буфером - добавление основания к этой смеси нейтрализует часть кислоты, но соль останется неизменной. Кроме того, добавление кислоты не вызовет реакции, по крайней мере, до тех пор, пока сильнокислые условия не начнут вытеснять хлористый водород. Иная ситуация, когда мы имеем дело с плохо диссоциирующей кислотой.
В растворе уксусной кислоты некоторые молекулы принимают нейтральную форму Ch4COOH. Такая молекула может отдавать протон, значит, это кислота. Часть уксусной кислоты в растворе диссоциировала, высвобождая протон. Образовавшийся кислотный остаток, анион Ch4COO-, может принимать протон и, следовательно, является основанием. Конечно, в этих условиях между ними существует равновесие, и протон дается и принимается снова и снова. Однако примечательно то, что акцептирование протона ацетат-ионом выводит его из раствора. В случае соляной кислоты ионы водорода из кислоты присутствовали в растворе все время из-за его хорошей диссоциации, здесь они объединяются в нейтральную молекулу кислоты и не влияют на pH раствора
Добавление небольшого количества количество кислоты сдвигает равновесие - некоторые анионы ацетата будут поглощать избыточное количество протонов.Таким образом, они исчезнут из раствора, а pH снизится меньше, чем добавленное количество. Добавление небольшого количества основания нейтрализует небольшое количество ионов гидроксония, поэтому меньшее их количество будет связываться с ионами ацетата, а в результате дисбаланса немного больше кислоты будет диссоциировать, чтобы подкисить раствор, так что увеличение pH будет меньше, чем в результате добавления количества основания.
Сколько кислоты или основания можно добавить, зависит от их количества в растворе. В одной только уксусной кислоте ацетат-анионов не так много, поэтому преодолеть такое сопротивление несложно.Чтобы механизм проявлял себя при полном освещении и противостоял большему количеству реагентов, образуются смеси слабых электролитов и их растворимых солей, предпочтительно в том же количестве.
Уксусная кислота, смешанная с соответствующим количеством ацетата натрия, таким образом, дает ацетатный буфер, который будет поддерживать pH в диапазоне 3-6 в зависимости от соотношения кислоты к соли. Аммиачный раствор с добавкой хлорида аммония представляет собой аммиачный буфер с pH 8-11. Борная кислота, растворенная боратом натрия, представляет собой боратный буфер с pH 7-9.
Каждый такой раствор содержит относительно большое количество диссоциированных и недиссоциированных форм, благодаря чему он может буферизовать pH, нарушенный добавками электролита в количествах аналогичного порядка. Буферы используются там, где необходима постоянная, четко выраженная реакция, не нарушаемая примесями. Многие измерения свойств вещества производятся в буферных растворах, которые поддерживают известное значение pH на протяжении всего измерения. По получении буферы также могут храниться в течение более длительных периодов времени.
Работу буфера можно пояснить еще наглядно - как соединенные сосуды. Если мы нальем раствор в одно плечо частично заполненной U-образной трубки, мы нарушим баланс. Однако система будет вести себя извращенно - часть раствора будет перетекать в другое плечо, пока оно не восстановит равновесие. Уровень в руке, в которую мы налили жидкость, увеличится вдвое по сравнению с добавленным количеством, потому что часть жидкости слилась. Однако вы не можете делать это бесконечно, потому что в конце концов в трубке не останется места, и другая рука не сможет это компенсировать, потому что в ней также закончится свободный объем.
То же самое и с буферами - они могут остановить изменения реакции при количествах кислот или оснований, меньших или сопоставимых с их собственной концентрацией. Однако они не справляются с большими количествами - после полной диссоциации и нейтрализации слабой кислоты буфер перестает сопротивляться основаниям, после полного протонирования аниона кислотного остатка раствор перестает сопротивляться добавкам кислоты.
Количество реагента, необходимое для разрушения буфера, определяется емкостью буфера. Это зависит от степени разбавления и соотношения диссоциированной формы к недиссоциированной.
Вот и все.
.экспериментов с пищевой содой | Pupus.pl
Пищевая сода - незаменима в домашнем хозяйстве: ведь она пригодится как на кухне, так и в ванной - для уборки или стирки. Ну а сегодня о том, как использовать газировку для развлечения: для экспериментов, несложных опытов, которые можно проводить дома с детьми.
Знакомство с пищевой содой
Пищевая сода - это бикарбонат натрия. В твердом виде это белый порошок, который безопасен на ощупь и даже на вкус.Пищевая сода хорошо растворяется в воде. В которой. Если проверить реакцию полученного раствора - он будет слабощелочным. Вот почему пищевая сода используется при изжоге - для нейтрализации желудочного сока:
NaHCO 3 + HCl → NaCl + H 2 O + CO 2 ↑
Выделение углекислого газа в результате термического разложения способствует росту теста для выпечки:
2NaHCO 3 → Na 2 CO 3 + H 2 O + CO 2 ↑
Опыт: Дом "Вулкан"
Для опыта нам понадобится:
Соотношение соды и уксусной кислоты составляет 1: 1 по весу (если какой-либо из ингредиентов больше, он просто не вступит в реакцию).Имейте в виду, что уксус - это раствор уксусной кислоты.
- пищевой краситель (возможно)
- поднос или чаша (что-то для защиты окружающей среды от разлива лавы)
- высокий сосуд - например, мерный цилиндр или высокий стакан (хорошо подходит сосуд с узким отверстием)
Ход эксперимента
Насыпьте пищевую соду в высокую емкость.Выкладываем краситель в уксусе. Обильно влейте уксус в соду.
Восхищаемся результатом работы.
NaHCO 3 + CH 3 COOH → CH 3 COONa + H 2 O + CO 2 ↑
Выделение углекислого газа приводит к появлению эффекта (взрывоопасная пена).
Опыт: надувание воздушного шара без помощи рта.
В этом эксперименте также используется реакция пищевой соды с уксусом.Однако на этот раз высвободившийся диоксид углерода будет использован для наполнения баллона, прикрепленного к бутылке или другому сосуду.
Для опыта нам понадобится:
- сода пищевая
- уксус
- Высокие сосуды - например, бутылки
- воздушный шар
Насыпьте в воздушный шарик пищевую соду (1 столовая ложка) и уксус в бутылку. Однако реакция протекает в соотношении 1: 1 - если один из субстратов отсутствует, другой просто не вступит в реакцию.И поэтому вы должны учитывать тот факт, что пищевой уксус - это не 100% уксусная кислота, а раствор, поэтому уксус можно принимать в большем весе, чем пищевая сода.
Наденьте баллон на горлышко бутылки и вылейте его содержимое в уксус. Выделяющийся углекислый газ поднимется и наполнит шар.
Эти два эксперимента чрезвычайно просты. Их можно сделать с помощью дошкольников, а с учетом того, что ингредиенты, использованные в опытах, безвредны - это безопасные эксперименты.
.Что тяжелее кислоты или воды. Неправильное смешивание концентрированной серной кислоты с водой (как это выглядит на практике). Анекдот о нем от Владимира Вольфовича
При смешивании концентрированной серной кислоты и воды выделяется много тепла. Для химика этот факт очень важен, потому что как в лаборатории, так и на производстве часто бывает необходимо приготовить разбавленные растворы серной кислоты. Для этого нужно смешивать концентрированную серную кислоту с водой - не всегда, но часто.
Как смешать концентрированную серную кислоту и воду? ?
Всем мануалам и мастер-классам Я настоятельно рекомендую залить серной кислотой (тонкой струйкой и при хорошем перемешивании) - не наоборот: не наливайте воду в концентрированную серную кислоту!
Почему? Серная кислота тяжелее воды.
Если вы вылейте кислоту в воду тонкой струйкой, она опустится на дно. Тепло, которое будет выделяться при перемешивании, рассеется - пойдет на нагрев всей массы раствора, так как над слоем кислоты, выпавшей на дно сосуда, находится большое количество воды.
Тепло рассеивается, раствор нагревается - и ничего страшного не произойдет, особенно если жидкость хорошо перемешивается при добавлении кислоты в воду.
Что будет, если вы это сделаете? неверно , - добавить воду в концентрированную серную кислоту? Как только первые количества воды достигнут серной кислоты, они останутся на поверхности (потому что вода легче концентрированной серной кислоты). Различают много тепла, которое будет использовано для отопления небольшого количества вода.
Вода будет бурно закипать, вызывая брызги серной кислоты и едкий аэрозоль. Эффект можно сравнить с добавлением воды в горячую масляную сковороду. Серная кислота может попасть в глаза, кожу и одежду. Аэрозоль серной кислоты не только очень неприятен для вдыхания, но и опасен для легких.
Если стекло не жаростойкое, посуда может разбиться.
Чтобы упростить запоминание этого правила, придумали особые рифмы вроде:
«Сначала вода, потом кислота - а то будет большая проблема!»
Еще они используют специальные фразы, которые нужно запомнить - «мемы», например:
«Лимонный чай».
Книжки хорошие, но я решил сфотографировать, как выглядит на практике результат неправильного смешивания концентрированной серной кислоты с водой.
Конечно, соблюдая все меры предосторожности: от очков до использования небольших количеств веществ.
Провел несколько экспериментов - попытался смешать серную кислоту с водой (хорошо и плохо). В обоих случаях наблюдался только сильный нагрев. Но готовки, брызг и тому подобного не произошло.
В качестве примера опишу один из экспериментов, проведенных в пробирке.Я взял 20 мл концентрированной серной кислоты и 5 мл воды. Обе жидкости имеют комнатную температуру.
Я начал добавлять воду в серную кислоту. Вода не закипала до тех пор, пока в кислоту не были добавлены первые порции воды. Новые порции воды гасили кипение. Вылетел каустический аэрозоль (я не был готов к этому, пришлось уйти на несколько секунд). Пробовал смешивать с алюминиевой проволокой (которая была под рукой). Эффект нулевой. Я измерил температуру градусником. Оказалось, 80 градусов по Цельсию.Эксперимент не удался.
Новый эксперимент проводился в колбе: так, чтобы площадь контакта двух жидкостей была максимальной (это обеспечивало более резкое тепловыделение), а толщина слоя воды над серной кислотой была минимальной. Добавляла воду не сразу, а небольшими порциями (чтобы от тепла вскипела вода, а не вся масса воды).
Таким образом, в коническую колбу налили примерно 10-15 мл концентрированной серной кислоты. Я использовал около 10 мл воды.
При подготовке к эксперименту кислота нагревается до 36-37 градусов под палящим солнцем (что на 20 градусов выше, чем начальная температура кислоты в предыдущем эксперименте).Вода в пробирке тоже немного подогрета, но не так сильно. Думаю, это сыграло большую роль в успехе эксперимента.
Когда большая часть воды добавлялась к серной кислоте, явно выделялись брызги и едкий аэрозоль. К счастью, их унесло ветром с моей стороны, так что я даже ничего не почувствовал.
В результате температура в трубке поднялась выше 100 градусов!
Какие выводы можно сделать? Если вы нарушите правило , не добавляйте воду в концентрированную серную кислоту . Брызги не всегда случаются, но они возможны, особенно когда вода и кислота теплые.Особенно если добавлять воду медленно, небольшими порциями и в широкой миске.
При работе с большим количеством воды и кислоты увеличивается вероятность внезапного перегрева и брызг (помните: мы взяли всего несколько миллилитров).
Опыт показывает не добавлять воду в концентрированную серную кислоту , описанный в мастерской авторов Рипана и Четиану.
Вот цитата:
Если в концентрированную серную кислоту налить воду, первые попадающие в нее капли тут же превращаются в пар, а брызги жидкости вылетают из сосуда.Это связано с тем, что вода с низким удельным весом не погружается в кислоту, а кислота из-за своей малой теплоемкости не поглощает выделяющееся тепло. При заливке горячей воды наблюдается более сильный всплеск серной кислоты.
Опыт . Смешивание воды с концентрированной H 2 SO 4 ... Стакан концентрированной серной кислоты ставится на дно большого стакана, закрытого воронкой. Теплая вода подается с помощью пипетки (рис. 161). После заливки горячей воды внутренние стенки большого стакана и воронки сразу же покрываются брызгами жидкости.
Рис. 161
Если стеклянной воронки нет, можно использовать картонную воронку, в которую вставлена пипетка с водой.
Если вы наливаете концентрированную серную кислоту в стакан с водой по каплям или тонкой струйкой, вы можете увидеть, как более тяжелая серная кислота опускается на дно стакана.
При смешивании концентрированной Н 2 SO 4 со льдом одновременно могут наблюдаться два явления: гидратация кислоты с выделением тепла и таяние льда с поглощением тепла.Следовательно, в результате перемешивания может наблюдаться повышение или понижение температуры. Так, при смешивании 1 кг льда с 4 кг кислоты температура повышается почти до 100 °, а при смешивании 4 кг льда с 1 кг кислоты температура падает почти до -20 °.
В разделе, посвященном вопросу Что произойдет, если в воду налить кислоту и наоборот, если добавить воду к кислоте, указанной автором Профиль удален лучший ответ - Вы должны налить в воду серную кислоту, тогда все будет в порядке.
А если наоборот ... она хоть пробирку порвет, а в лучшем случае тебе больно, когда котенок начнет брызгаться и обжигать тебя.
Вода легче серной кислоты. Температура плавления составляет 10,37 ° C с теплотой плавления 10,5 кДж / моль. Это много. - если в серную кислоту влить воду, то во время настаивания вода закипит и начнет брызгать.
Ответ от Деминов Анатолий [гуру]
Начинает кипеть и плескаться ...
Ответ электросварщика [гуру]
реакция))), а вот воду в кислоту заливать, лучше не стоять рядом и не вдыхать и не сунуть туда глаза...
Ответ от Neurosis [гуру]
Я слышал эту фразу, идет кислота ...
Ответ от Колоски [гуру]
слабая кислота или водный раствор ... =))
Ответ от Herchilla [guru]
Второй может быть изготовлен только в костюмах химической защиты.
Ответ от Анатолий Подплетный [гуру]
В первом случае кислота тяжелее и сразу уходит на дно, остается только помешать и будет электролит! А во втором случае, если без очков, лёгкая вода начнет брызгать и обжигать глаза !!
Ответ от ****** [guru]
Либо тебя заметят - либо наоборот! Кислая вода - НЕ КАТЕГОРАЛЬНО! Выбрасывание в виде пятен - глаза - лицо - ожоги - слепота - потеря красоты - несовершенное по глупости !!
Ответ от Михаил Бармин [гуру]
Диссоциация (растворение происходит с выделением большого количества тепла.Вылейте вещество большей плотности в вещество меньшей плотности, что приведет к лучшему перемешиванию и меньшей скорости, в противном случае ВЫПУСТИТЕ раствор и ПОВРЕДИТЕ ГЛАЗА !!
Ответ от Ира Юшинова [Новичок]
Зависит от типа кислоты. В случае с азотной и соляной кислотой ничего страшного не произойдет, кислоты просто нагреются. Соленая вода станет теплее. В случае серной кислоты реакция будет протекать с большим выделением тепла.В первом случае серная кислота опустится на дно, благодаря чему вода будет иметь меньшую плотность, и реакция пройдет благополучно. В последнем случае реакция будет происходить на поверхности с большим выделением тепла. То же самое происходит, когда вы роняете воду в горячую кастрюлю. Но со временем кислота поглотит воду.
Для безопасности и удобства использования рекомендуется покупать максимально разбавленную кислоту, но иногда нужно разбавить ее еще больше в домашних условиях. Не забывайте носить средства защиты тела и лица, так как концентрированные кислоты вызывают сильные химические ожоги.Чтобы рассчитать необходимое количество кислоты и воды, вам необходимо знать молярность (M) кислоты и молярность раствора, который вы хотите получить.
Ступеньки
Как рассчитать формулу
Проверьте, что у вас уже есть. Найдите символ концентрации кислоты на упаковке или в описании работы. Обычно это значение обозначается как молярность или молярная концентрация (сокращенно - М). Например, 6М кислота содержит 6 молей молекул кислоты на литр. Назовем это начальной концентрацией C 1 .
- В формуле также будет использоваться значение V 1 ... Это объем кислоты, который будет добавлен в воду. Вероятно, нам не понадобится вся бутылка кислоты, хотя мы еще не знаем ее точное количество. 90 160
-
Решите, каким должен быть результат. Необходимая концентрация и объем кислоты обычно указываются в тексте химического задания. Например, нам нужно разбавить кислоту до 2M и нам нужно 0,5 литра воды. Обозначим требуемую концентрацию как C 2 и необходимый объем как V 2 .
- Если указаны другие единицы, сначала преобразуйте их в единицы молярности (моль на литр) и литры.
- Если вы не знаете, какая концентрация или объем кислоты необходимы, спросите своего учителя или кого-нибудь, кто хорошо разбирается в химии. 90 160
-
Напишите формулу для расчета концентрации. Каждый раз, когда вы разбавляете кислоту, вы будете использовать следующую формулу: C1V1 = C2V2 ... Это означает, что начальная концентрация раствора, умноженная на его объем, равна концентрации разбавленного раствора, умноженной на его объем.Мы знаем, что это правда, потому что концентрация, умноженная на объем, равна общему количеству кислоты, а общее количество кислоты останется прежним.
- Используя данные из примера, запишем эту формулу как (6M) (V1) = (2M) (0.5L) . 90 160
-
Решите уравнение V 1 . V 1 сообщит нам, сколько концентрированной кислоты нам нужно, чтобы получить желаемую концентрацию и объем. Запишем формулу как V 1 = (C 2 V 2) / (C 1) , а затем заменим известные числа.
- В нашем примере мы получаем V 1 = ((2M) (0,5L)) / (6M). Это эквивалентно примерно 167 миллилитрам. 90 160
-
Рассчитайте необходимое количество воды. Зная V 1 - доступный объем кислоты и V 2 - количество полученного раствора, вы можете легко вычислить, сколько воды вам нужно. V 2 - V 1 = необходимое количество воды.
- В нашем случае мы хотим получить 0,167 литра кислоты на 0,5 литра воды. Нам нужно 0,5 литра - 0,167 литра = 0,333 литра, или 333 миллилитра. 90 160
-
Надевайте защитные очки, перчатки и фартук. Вам потребуются специальные очки, закрывающие глаза и по бокам. Надевайте перчатки и халат или фартук, чтобы избежать ожогов кожи и одежды.
Работайте в хорошо вентилируемом помещении. По возможности работайте под колпаком, когда он включен - чтобы пары кислоты не повредили вам и окружающим предметам. Если у вас нет вытяжки, откройте все окна и двери или включите вентилятор.
Узнайте, где находится источник проточной воды. При попадании кислоты в глаза или на кожу необходимо промыть пораженный участок под холодной проточной водой в течение 15-20 минут. Не приступайте к работе, пока не узнаете, где находится ближайшая раковина.
- Держите глаза открытыми во время полоскания. Посмотрите вверх, вниз, по сторонам, чтобы глаза покраснели со всех сторон. 90 160
-
Знайте, что делать, если вы пролили кислоту. Вы можете приобрести специальный комплект для удаления пролитой кислоты, который включает все необходимое, или вы можете приобрести нейтрализаторы и абсорбенты отдельно. Описанный ниже процесс применим к соляной, серной, азотной и фосфорной кислотам. Другие кислоты могут потребовать другого обращения.
- Проветрите комнату, открыв окна и двери и включив вытяжку и вентилятор.
- Нанесите немного карбоната натрия (соды), бикарбоната натрия или карбоната кальция на внешние края бассейна, избегая разбрызгивания кислоты.
- Постепенно заполните всю лужу по направлению к центру, пока полностью не покроете нейтрализующим агентом.
- Тщательно перемешайте пластиковой палочкой. Проверьте значение pH в бассейне лакмусовой бумажкой. Добавьте больше нейтрализующего вещества, если его больше 6-8, затем промойте пораженный участок большим количеством воды. 90 160
-
Охладите воду льдом. Это следует делать только в том случае, если вы будете работать с кислотами с высокой концентрацией, например 18M серной кислотой или 12 миллионами соляной кислоты.Налейте воду в емкость, поставьте емкость на лед не менее 20 минут.
- Обычно достаточно воды комнатной температуры. 90 160
-
Налейте в большую колбу дистиллированную воду. Для задач, требующих особой точности (например, для анализа титрования), используйте мерную колбу. Для всех остальных целей подойдет обычная коническая колба. Емкость должна вмещать весь необходимый объем жидкости, а также должно быть место, чтобы жидкость не разбрызгивалась.
- Если емкость емкости известна, нет необходимости точно измерять количество воды. 90 160
-
Добавьте немного кислоты. Если вы работаете с небольшим количеством воды, используйте градуированную пипетку или резиновый наконечник. Если объем большой, поместите воронку в колбу и аккуратно пипетируйте кислоту небольшими порциями.
- Не используйте пипетки в химической лаборатории, где воздух должен всасываться через рот. 90 160
-
Дайте раствору остыть. Сильные кислоты могут выделять много тепла при контакте с водой. Если кислота концентрированная, раствор может закипеть и разбрызгаться с образованием токсичных паров. Если вы столкнулись с этим, начните добавлять кислоту в еще меньших количествах или охлаждать воду на льду.
Влейте оставшуюся кислоту небольшими порциями. Дайте раствору остыть между партиями, особенно если вы чувствуете тепло или замечаете пары и брызги. Продолжайте добавлять кислоту, пока не закончите.
- Требуемая сумма была рассчитана как V 1 выше. 90 160
-
Размешайте раствор. Лучше всего перемешивать жидкость после каждого добавления кислоты. Если колба не позволяет, помешивайте раствор в последнюю очередь после снятия воронки.
Удалить кислоту и промыть инструменты. Перелейте этот раствор в подписанный контейнер, желательно в стеклянную бутылку, и храните его в надежном месте. Промойте колбу, воронку, мешалку, пипетку и / или мерную колбу, чтобы удалить остатки кислоты.
- должно быть много кислоты, так как она расходуется после разрядки аккумулятора, способствуя снижению уровня электролита и появлению соли на свинцовых пластинах;
- когда аккумулятор заряжен, уровень дистиллированной воды падает, увеличивая плотность кислоты, поэтому плотность большинства аккумуляторов составляет 1,27 г / см3;
- : если кислоты не так много, как нужно, электролит при низкой температуре воздуха превратится в лед;
- Если вы добавите в дом кислоты больше, чем воды, она разрушит плитку.
- Никогда не добавляйте жидкость сразу после выключения двигателя. Она должна довольствоваться минимум шестью-восемью часами. Только после «отдыха» можно вскрыть аккумулятор и начать процесс заправки.
- После заполнения водой также невозможно сразу запустить устройство. Подождите хотя бы до следующего утра, иначе может закипеть, что приведет к фатальным последствиям.
- Добавление дистиллята не сделает прибор новым, а лишь немного улучшит его работу. Если аккумулятор уже израсходовал свои ресурсы, лучше заменить его на новый.
- Перед запуском аккумулятора проверьте количество жидкости внутри. Запускать его можно только тогда, когда уровень воды в пределах нормы.
- И ни в коем случае не используйте для доливки обычную воду, а только специальную дистиллированную воду, купленную в специальной. магазины в закрытой таре.При заливке простой воды пластины разрушатся и аккумулятор полностью выйдет из строя.
- Аккумулятор следует заливать водой комнатной температуры в закрытом помещении.
- Кислоты должно быть достаточно, потому что при разряде аккумулятора она разряжается, падает плотность электролита - на пластинах выделяются соли.А при зарядке наоборот вода расходуется, плотность кислоты увеличивается. Если кислоты недостаточно, процесс зарядки и разрядки будет не таким эффективным. Поэтому сейчас плотность многих аккумуляторов составляет около 1,27 г / см3.
- Если кислоты не хватает, электролит просто замерзает при минусовых температурах. Разряженный аккумулятор может превратиться в лед при температуре - 3, - 5 градусов.
- Если налить много кислоты, намного больше (например, 2 массовые доли и одна массовая доля воды), это может негативно повлиять на плитку.Выпадет больше соли, и эта концентрация разрушит плитки быстрее.
Как разбавить кислоту?
Как смешать два жидких вещества? Хотите кислоты и воды? Казалось бы, это задание из серии «два раза два - четыре».Что может быть проще: налейте обе жидкости в соответствующий контейнер, и готово! Или вылейте одну жидкость в емкость, в которой уже есть другая. К сожалению, именно эта простота, как известно, хуже воровства. Потому что дело может закончиться крайне печально!
Инструкции
Имеются две емкости: одна для концентрированной серной кислоты, а другая - для воды. Как их правильно перемешать? Налить кислоту в воду или, наоборот, воду в кислоту? Стоимость ошибочного решения теоретически может быть невысокой, но на практике - в лучшем случае - серьезный ожог.
Почему? Но потому что концентрированная серная кислота, во-первых, намного плотнее воды, а во-вторых, она чрезвычайно гигроскопична. Другими словами, он активно впитывает воду. В-третьих, это поглощение сопровождается выделением большого количества тепла.
Если в емкость налить воду с концентрированной серной кислотой, первые порции воды «разольются» по поверхности кислоты (потому что вода намного менее плотная), и кислота будет жадно ее поглотить, выделяя тепло. И эта жара будет такой сильной, что вода буквально «закипит» и брызги разлетятся во все стороны.Конечно, не забывая о несчастном экспериментаторе. Обжечься «чистым» кипятком - неприятно, а если учесть, что в обрызгиваемой воде наверняка еще будет кислота. Перспектива становится очень скучной!
Поэтому многие поколения учителей химии заставляли своих учеников буквально помнить принцип: «Сначала вода, потом кислота! Иначе случится большая проблема! " Концентрированную серную кислоту следует добавлять в воду небольшими порциями при перемешивании.Тогда не возникнет описанная выше неприятная ситуация.
Резонный вопрос: с серной кислотой все понятно, а как насчет других кислот? Как правильно смешать их с водой? В каком порядке? Вам нужно знать плотность кислоты. Если она плотнее воды, например концентрированный азот, ее следует влить в воду так же, как и серную воду, соблюдая указанные выше условия (точками, перемешивание). Что ж, если плотность кислоты очень немного отличается от плотности воды, как в случае с уксусной кислотой, это не имеет значения.
Внимание, только СЕГОДНЯ!
Все интересное
Повышенное внимание и забота, а также соблюдение специальных мер безопасности - обязательное условие при работе с кислотами. С кислотами могут работать лица старше 18 лет, при условии прохождения курса ...
Серная кислота - неорганическая кислота средней силы. Из-за нестабильности его нельзя кипятить в водном растворе с концентрацией более 6%, иначе он начнет разлагаться на серный ангидрид и воду.Химические свойства сернистая кислота
Серная кислота представляет собой маслянистую бесцветную жидкость без запаха. Он относится к сильным кислотам и растворим в воде в любых соотношениях. Он имеет колоссальное промышленное применение. Серная кислота достаточно тяжелая жидкость, ее плотность ...
Серная кислота по физическим свойствам - тяжелая маслянистая жидкость. Не имеет запаха и цвета, гигроскопичен и легко растворяется в воде. Раствор, содержащий менее 70% h3SO4, обычно называют разбавленной серной кислотой, более 70% -...
Соляная кислота (соляная, HCl) - бесцветная, очень едкая и ядовитая жидкость, раствор хлороводорода в воде. В высокой концентрации (38% от общей массы при температуре окружающей среды 20 ° C) - «дым», туман и пары ...
Серная кислота имеет химическую формулу h3SO4. Это тяжелая маслянистая жидкость, бесцветная или с желтоватым оттенком из-за примесей в ионах металлов, таких как железо. Серная кислота очень гигроскопична, легко впитывает водяной пар ...
Серная кислота входит в пятерку самых сильных кислот.Необходимость нейтрализовать эту кислоту возникает особенно в случае ее утечки и риска отравления. Инструкция 1 Молекула серной кислоты состоит из двух атомов ...
Долгое время учителя, объясняя, как смешать концентрированную серную кислоту с водой, заставляли учеников помнить правило: «Сначала вода, потом кислота!» Дело в том, что если сделать наоборот, первые порции будут легче ...
Серная кислота, имеющая химическую формулу h3SO4, представляет собой тяжелую густую жидкость маслянистой консистенции.Он очень гигроскопичен, легко смешивается с водой, но в воду нужно заливать кислоту, а не наоборот ...
В каждой машине есть источник питания, этим источником является аккумулятор. Поскольку аккумулятор представляет собой элемент многоразового использования, его можно заряжать и менять электролит. До этого и кислоты, и ...
Сульфаты железа относятся к неорганическим химическим веществам, они делятся на разновидности. Есть сульфат железа (2) и сульфат железа (3). Есть много способов получить эти сульфатные соли.Вам понадобится железо ...
Что произойдет, если соединить кислоту с солью? Ответ на этот вопрос зависит от того, какая это кислота и какая это соль. Химическая реакция (то есть превращение веществ, сопровождающееся изменением их состава) между кислотой и солью может ...
Как смешать два жидких вещества? Хотите кислоты и воды? Казалось бы, это задание из серии «два раза два - четыре». Что может быть проще: налейте обе жидкости в соответствующий контейнер, и готово! Или вылейте одну жидкость в емкость, в которой уже есть другая.К сожалению, именно эта простота, как известно, хуже воровства. Потому что дело может закончиться крайне печально!
Инструкции
Есть две емкости: одна содержит концентрированную серную кислоту, а другая - воду. Как их правильно перемешать? Налить кислоту в воду или, наоборот, воду в кислоту? Стоимость ошибочного решения теоретически может быть невысокой, но на практике - в лучшем случае - серьезный ожог.
Почему? Но потому что концентрированная серная кислота, во-первых, намного плотнее воды, а во-вторых, она чрезвычайно гигроскопична.Другими словами, он активно впитывает воду. В-третьих, это поглощение сопровождается выделением большого количества тепла.
Если в емкость налить воду с концентрированной серной кислотой, первые порции воды «разольются» по поверхности кислоты (потому что вода намного менее плотная), и кислота будет жадно ее поглотить, выделяя тепло. И эта жара будет такой сильной, что вода буквально «закипит» и брызги разлетятся во все стороны. Конечно, не забывая о несчастном экспериментаторе.Обжечься «чистым» кипятком - неприятно, а если учесть, что в обрызгиваемой воде наверняка еще будет кислота. Перспектива становится очень скучной!
Поэтому многие поколения учителей химии заставляли своих учеников буквально помнить принцип: «Сначала вода, потом кислота! Иначе случится большая проблема! " Концентрированную серную кислоту следует добавлять в воду небольшими порциями при перемешивании. Тогда не возникнет описанная выше неприятная ситуация.
Резонный вопрос: с серной кислотой все понятно, а как насчет других кислот? Как правильно смешать их с водой? В каком порядке? Вам нужно знать плотность кислоты. Если она плотнее воды, например концентрированный азот, ее следует влить в воду так же, как и серную воду, соблюдая указанные выше условия (точками, перемешивание). Что ж, если плотность кислоты очень немного отличается от плотности воды, как в случае с уксусной кислотой, это не имеет значения.
.Сколько дистиллированной воды нужно налить в аккумулятор. Как долить воды в аккумулятор в домашних условиях. Как долить воду в необслуживаемую батарею без доступа к банкам
Довольно часто начинающих водителей беспокоит, что такое дистиллированная вода и почему ее нужно добавлять в автомобильный аккумулятор в любое время года. Принимая это во внимание, некоторые отмечают, что дистиллят может принести больше вреда, чем пользы, хотя эта информация не подтверждена.
Стоит попытаться выяснить, что будет с аккумулятором, если в него налить обычную водопроводную воду и сколько нужно будет залить дистиллированной воды для исправной работы устройства.Профессиональные водители, хорошо разбирающиеся во всех тонкостях состава электрохимических жидкостей в аккумуляторе.
Дистиллированная вода входит в состав электролита, без которого невозможно приготовить жидкость электрохимического типа, так как она может создавать состав необходимой плотности и добавлять полезные свойства. Если вы не добавите эту воду в аккумулятор, устройство не будет работать как можно лучше.

Дело в том, что электролит состоит из тридцати процентов серной кислоты и шестидесяти пяти процентов дистиллята.Конечно, ясно, что чистая кислота просто разъела свинцовые пластины и отключила батарею ... Это дистиллированная вода, которая помогает значительно снизить концентрацию серной кислоты, позволяя батарее нормально функционировать.
Проверить время зарядки аккумулятора
По школьному курсу химии можно понять, что дистиллированная вода - чистейшее вещество, в котором нет примесей и солей. Стоит отметить, что воду из-под крана не следует заливать в кран вместо дистиллированной, так как она далеко не идеальна.В такой жидкости не только много примесей и солей, но и опасный элемент - хлор.
Если вместо дистиллированной воды налить водопроводную воду, на свинцовых пластинах осядут загрязнения, и емкость аккумулятора значительно снизится. Это означает, что вода из-под крана разрушает аккумулятор, и, если вылить ее в устройство, она в конечном итоге выйдет из строя.
Как рассчитать количество добавляемой воды?
Для правильной работы автомобильного аккумулятора важно понимать, сколько дистиллированной воды вам нужно долить.Согласно технической документации соотношение кислоты к дистилляту не превышает 1: 2. Чтобы узнать, сколько дистиллированной воды нужно добавить в автомобильный аккумулятор, стоит разобраться, сколько в ней кислоты.
Почему важно правильно рассчитать количество добавляемой воды:
Соотношение кислоты и воды, например 1: 2, было экспериментально получено много лет назад, поэтому категорически запрещено изменять его в любом направлении. Каждому автовладельцу необходимо знать, сколько дистиллированной воды в аккумуляторе, чтобы своевременно доливать ее своими руками до необходимого уровня.
Правила добавления дистиллята в батарею

Пожалуйста, ознакомьтесь с правилами добавления дистиллята с помощью видео, чтобы правильно добавлять дистиллированную воду в аккумулятор и не повредить автомобиль:
Чтобы правильно долить дистиллированную воду, необходимо определить уровень электролита в аккумуляторе с помощью специальной трубки, диаметр которой не менее пяти миллиметров.
Для достижения необходимого уровня электролита дистиллят набирают в шприц из двадцати кубиков и добавляют по пять или десять миллилитров жидкости в каждую секцию батареи.
После доливки дистиллированной воды аккумулятор необходимо заряжать, не закрывая крышки банки, по крайней мере, четыре раза для восстановления емкости. Затем крышки закрываются, и аккумулятор заряжается примерно двенадцать часов.
Не забывайте, какие меры предосторожности следует соблюдать в этом процессе, поэтому вы должны носить защитные очки и перчатки и держаться подальше от открытого огня.
Чтобы при закипании электролита его плотность существенно не увеличивалась, необходимо своевременно доливать аккумулятор дистиллированной водой. Как правильно долить в аккумулятор дистиллированную воду? Давайте подробнее рассмотрим этот процесс.
Особенности розлива дистиллята
Перед началом процесса заправки дистиллятом (электролитом) подготовьте аккумулятор. Его необходимо выключить, снять, установить на ровную поверхность, очистить от пыли и грязи.Очистка аккумулятора является обязательной, так как даже мельчайшие частицы грязи могут привести к полному выходу аккумулятора из строя при проглатывании. Самый простой способ очистить аккумулятор - это использовать раствор пищевой соды.

Внутри блока питания есть специальная маркировка, указывающая минимальный и максимальный уровень дистиллята.
Чтобы грязь не попала в аккумулятор, используйте обычный шприц для наполнения дистиллированной водой. Он позволит вам наливать жидкости не только абсолютно гигиенично, но и максимально аккуратно.
После заполнения закройте аккумулятор и установите его на место.

Электролит представляет собой раствор воды и серной кислоты, который заливается внутрь аккумулятора (AB). Во время работы от батареи вода разлагается на кислород и водород, который выходит через вентиляционные отверстия. Соответственно, уровень электролита в результате разложения воды будет снижаться, и водителю придется периодически доливать дистиллированную воду в AB.
Перед этим необходимо тщательно очистить крышку АКБ от пыли и грязи , которые могут содержать капли серной кислоты. Это необходимо для предотвращения попадания пыли и грязи в банки AB и на одежду.
Большинство AB сегодня производятся в прозрачной упаковке, и очень легко сказать, в какие банки нужно добавлять дистиллированную воду. Кроме того, на корпусе аккумуляторной батареи нанесены минимальные и максимальные значения заливаемого электролита.Для удобства добавления воды можно использовать медицинский шприц. Уровень электролита должен быть на 1-1,5 см выше положения пластин. Ни в коем случае нельзя заливать дистиллированную воду сверх необходимой нормы.
После заправки аккумулятора дистиллированной водой вам необходимо: измерить плотность электролита ... Но вы не можете сделать это сразу, так как ваши измерения будут неточными из-за медленного перемешивания жидкостей. Лучше всего это сделать на следующий день, после зарядки аккумулятора ... Плотность электролита при эксплуатации автомобиля в центральной части России должна составлять 1,27 г / см3, на юге - 1,25 г / см3, на севере - 1,29 г / см3. Мы измеряем этот ареометром .
Нет доступа к аккумуляторным батареям для необслуживаемых аккумуляторов. Но россияне тоже нашли выход. В такую сталь АВ шприцем с иглой долейте дистиллированную воду, пробив отверстие напротив емкости, куда ее нужно пополнить. Необходимость доливки можно определить по цвету индикатора.Если он белый, значит, в банку нужно добавить дистиллированную воду.
Меня очень часто спрашивают про автомобильный аккумулятор, для чего нужна дистиллированная вода? Почему его вообще выбрасывают, в чем польза или вред? Почему бы не вылить обычный кран, что будет? ДА и вообще сколько нужно заливать. Как видите, несмотря на простату, построение вопросов просто много, и все они связаны с этой жидкостью. Честно говоря, люди, которые мало разбираются в электрохимическом жидкостном составе батареи, не будут задавать такие вопросы, но для новичков эта информация будет очень полезна, так что читайте дальше...
Во-первых, небольшое определение.
- это незаменимый компонент электрохимической жидкости, просто электролит, который играет очень важную роль, а именно создает состав с необходимой плотностью и свойствами. Если в составе не было воды, кран работал не так, как должен.
90 120
Что это значит? ДА все просто - электролит на 35% состоит из дистиллированной воды и на 65%. Если просто налить серную кислоту, ее «сумасшедшая» концентрация просто все растопит (пусть и не сразу, но обязательно).Вода снижает концентрацию до желаемого предела, а затем кислота начинает действовать, создавая, а не разрушая. Также при таком соотношении начинают происходить процессы накопления электрической энергии в электролите при зарядке. Что, в свою очередь, позволяет вам потратить эту плату.
Что такое дистиллированная вода?
Что это на самом деле? Честно говоря, это вопрос к 6-7 классам средней школы, где они начинают углубляться в физику и химию.
Это не что иное, как «h3O» - то есть состав чистой воды, только два атома водорода и один кислород.Без примесей и солей - абсолютная чистота.

Если ответить на вопрос - почему нельзя залить в аккумулятор обычную водопроводную воду, ответ очень простой:
Состав, который течет из-под крана, сложно назвать «дистиллятором», потому что он содержит не только знаменитый h3O, но и массу всевозможных примесей, особенно соли, извести (в низких концентрациях), хлора и т. Д.
При попадании в батарею эти загрязнения неизбежно оседают на свинцовых пластинах батареи, что приводит к снижению ее емкости.Таким образом, обычная вода просто разрушит аккумулятор, поэтому его нельзя будет перелить.
Почему именно такое соотношение?
Теперь у многих может возникнуть вопрос - а почему именно такое соотношение кислоты и дистиллированной воды? ТОГДА есть одна массовая доля кислоты и две массовые доли воды.
90 150
Это по нескольким причинам:
Эта комбинация была получена эмпирически в результате довольно большого количества тестов.
Почему в аккумулятор заливается вода, а не электролит?
Тоже все просто - во время работы аккум нагревается (еще и летом нагревается, в жару), а после зарядки банки могут закипеть. В такие моменты из аккумулятора испаряется дистиллированная вода - ведь это его нормальное состояние (испарение при нагревании просто превращается в пар).Но кислота остается, она не «летучая» - соответственно увеличивается концентрация кислоты и уменьшается концентрация воды. Плотность может доходить до 1,4 г / см3. Чтобы привести электролит внутри аккумулятора в норму, нужно долить испарившуюся воду, так что долейте, кислота будет в нужных пропорциях.

Если вы добавите электролит, вы просто смешаете, скажем, 1,4 и 1,27 (которые вы купили), и вы получите около 1,33 г / см3 - и это много! Мы помним об осаждении соли и разрушении плит.
Значит, до нужной плотности нужно добавлять только дистиллированную воду, а не электролит! При смешивании создает необходимую для работы плотность.
Запомните это правило! Если честно, воду добавляли только в обслуживаемые аккумуляторы, потому что испарение там огромное. Но необслуживаемые аккумуляторы не требуют такого ухода, ведь они там в закрытом, плотно закрытом корпусе - жидкость испаряется, поднимается и снова выпадает в осадок - цикл замкнут.
Сколько воды нужно долить в аккумулятор?
Как мы выяснили, если есть необслуживаемый аккумулятор, то его практически не сколько, можно ездить на нем минимум пять лет и ни разу не проверять - это нормально! Но если у вас аккумулятор обслуживается, то есть заглушки откручиваются сверху, нужно постоянно следить за уровнем.

Сколько добавить дистиллированной воды - вопрос сложный - ведь она в любом случае будет иметь ценность. Она может колебаться, потому что чем больше батарея, тем больше в ней будет электролита, а это значит, что необходимо добавить больше воды.
Советую всегда иметь в машине литровую бутылку (в моих старых машинах на это у меня уходило 1,5 - 2 месяца - летом, зимой 3 - 4 месяца) - помните, если уровень электролита упал и ваши канистры голые, это критическое состояние, необходимо срочно разобраться в уровне закрытия платины.В противном случае они могут нагреться и рассыпаться.
Короткометражный фильм о том, каким должен быть уровень.
Машина не живой организм, а капризный. Всем известно, что в него нельзя заливать плохой бензин или солярку, антифриз и масло. Но для этого также нужна адекватная вода - дистиллированная! Рассматриваем, как использовать его с максимальной пользой для вашего железного коня.
Многие недоумевают, глядя на бутылки с прозрачной жидкостью с надписью «ГОСТ 6709-72»: мол, это просто вода, как она может стоить столько? Его даже нельзя пить!
Только дистиллированная вода - это не только вода, но и очищенная дистилляцией в дистилляторе.Он содержит минимальное количество примесей и имеет низкую удельную электропроводность. Поэтому при обслуживании автомобиля он незаменим и на нем не нужно экономить.
Мы предлагаем четыре способа использования дистиллированной воды:
1. Добавьте дистиллированную воду в батареи .
Добавление воды в аккумулятор после выкипания электролита - обычная, но очень ответственная процедура. В качестве разбавителя следует использовать только дистиллированную воду, иначе срок службы батареи сократится более чем в 2-3 раза.
Жидкость в батарее представляет собой раствор серной кислоты с добавками, дорогими и сложными ингредиентами, такими как ингибиторы саморазряда, соли бария и стронция. Эти добавки к электролиту сохраняют детали в целостности и обеспечивают стабильную работу аккумулятора.
Обычная вода содержит кальций, магний, железо, цинк и другие примеси - почти половину таблицы Менделеева! Если вы добавите его в батарею, будет нарушен хрупкий химический баланс.Пластины электродов покроются, аккумулятор начнет «шалить» - плохо заряжаться и ток держать не будет. Это вызовет проблемы с запуском.
2. Разбавьте антифриз дистиллированной водой, когда уровень охлаждающей жидкости упадет.
Вы могли заметить, что уровень охлаждающей жидкости в системе охлаждения со временем падает, хотя утечек нет. Это потому, что из антифриза испаряется вода.За год из системы охлаждения может исчезнуть до 1 литра охлаждающей жидкости. Разница между минимальным и максимальным уровнем антифриза обычно составляет всего 0,5 литра!
Чем ниже уровень охлаждающей жидкости, тем выше риск попадания воздуха в верхнюю часть радиатора, топку и охлаждающие каналы. В критический момент двигатель начнет перегреваться, в результате чего риск выхода из строя увеличится на порядок. Поэтому, если в системе охлаждения нет утечек и уровень жидкости упал, добавьте дистиллированную воду, чтобы восстановить концентрацию антифриза.Дистиллированную воду найти намного проще, чем подходящий хладагент. К тому же в этом случае не нужно думать о совместимости антифриза, и он в итоге выйдет дешевле.
Кстати, в автомастерских при замене антифриза для промывки системы охлаждения используют дистиллированную воду. Эта простая процедура предотвращает образование накипи и других вредных отложений. А чистота в системе охлаждения - гарантия того, что в работе двигателя не будет проблем.
 3. Используйте дистиллированную воду вместо омывателя стекла
3. Используйте дистиллированную воду вместо омывателя стекла
В инструкциях ведущих производителей автомобилей черным по белому написано, что в бачок омывателя можно заливать только дистиллированную воду. В противном случае в системе мойки появится известковый налет, осадок и даже грязь. Со временем этот мусор забивает форсунки и мешает их работе.
Дистиллированную воду в качестве промывочной жидкости можно использовать как отдельно, так и разбавленную концентратами спринклерных систем (как летом, так и зимой), которые намного лучше справляются с грязью или следами насекомых.
4. Используйте в доме дистиллированную воду
Белый известковый налет на черной ткани после глажки полностью чистой вещи - обычная проблема для людей, заливающих утюг простой водопроводной водой. Фильтрация и приготовление пищи с загрязнениями в водопроводной воде не справляются. Налейте в утюги дистиллированную воду, и тогда вам не будут страшны неприятные сюрпризы. Также его можно заливать в индивидуальную систему отопления в частном доме - он также чувствителен к вредным отложениям.
Производители электрокаминов рекомендуют также дистиллированную воду, в которой эффект пламени создается с помощью света и пара. Как и автомобильные системы, такие устройства очень требовательны к качеству жидкости и прослужат намного дольше, если в них налить дистиллированную воду.
.Можно ли смешивать радиаторные жидкости?
В большинстве случаев да. Для обеспечения безопасности, а также для обеспечения срока службы системы охлаждения рекомендуется смешивать жидкости с такими же параметрами и пакетами ингибиторов. Жидкости, произведенные по различным технологиям, например содержащие силикаты, с жидкостями, не содержащими их, не смешиваются. Жидкости старого поколения нельзя смешивать с новыми.
Представителям марки охлаждающих жидкостей Glixol даны ответы на вопросы, касающиеся радиаторных жидкостей.
Какова функция охлаждающей жидкости?
Основная функция жидкости - это, конечно, отвод тепла, а также защита и продление срока службы холодильной системы. Продукт хорошего качества должен предотвращать образование отложений и накипи в радиаторе, а также защищать его от коррозии. Что касается температуры, то при покупке жидкости обращайте внимание на предельные значения (от -35 до -37 ° C и от +110 до 140 ° C), потому что жидкость должна эффективно защищать систему охлаждения от замерзания. и перегрев.
Как часто нужно менять охлаждающую жидкость?
Охлаждающую жидкость следует менять каждые 3-5 лет - в зависимости от типа жидкости.
Могу ли я сам проверить и заменить жидкость?
Когда дело доходит до проверки состояния охлаждающей жидкости в нашем автомобиле, единственное, что мы можем сделать без услуг специалиста - это проверка уровня жидкости. Мы можем поменять жидкость сами, но я рекомендую посетить слесаря.Он не только профессионально заменит жидкость, но и утилизирует старую экологически безопасным способом. Тем более что стоимость замены жидкости невысока.
Имеют ли значение цвета при выборе жидкости?
Иногда обнаруживается, что цвет позволяет легко определить тип жидкости. Не так давно жидкости, содержащие органические соли, чаще всего были зеленого или синего цвета. Жидкости, содержащие органические кислоты, были окрашены в ярко-красный или оранжевый цвет, а жидкости, содержащие силикаты, были окрашены в темно-красный или пурпурный цвет.Сегодня мы уже не можем сказать, что цвет жидкости говорит нам о ее типе. Примером может служить жидкость, содержащая полипропиленгликоль зеленого цвета.
Охлаждающие жидкости окрашены, чтобы облегчить поиск утечек и избежать случайного проглатывания. К тому же они выполняют только декоративную функцию.
Можно ли смешивать жидкости друг с другом?
В большинстве случаев да. Для обеспечения безопасности, а также для обеспечения срока службы системы охлаждения рекомендуется смешивать жидкости с такими же параметрами и пакетами ингибиторов.
Различные типы жидкостей, например, содержащие силикаты, не смешиваются с жидкостями, которые этого не делают. Жидкости старого поколения нельзя смешивать с новыми.
А как насчет воды? Может ли он стать заменой жидкости?
Как в Интернете, так и в реальной жизни можно встретить мнения, что можно свободно использовать воду вместо охлаждающей жидкости. Надеюсь, все поймут, почему НЕЛЬЗЯ заливать воду в радиатор вместо охлаждающей жидкости.Все очень просто: вода замерзает при 0 ° C, а закипает при 100 ° C. Вода не может обеспечить оптимальное охлаждение, так как рабочая температура двигателя составляет около 90 ° C. Летом при высоких температурах вода не сможет эффективно отводить тепло, а при минусовых температурах не защитит систему от замерзания.
Итак, что следует учитывать перед покупкой охлаждающей жидкости?
Этикетка продукта должна содержать всю наиболее важную информацию:
- соответствуют ли параметры жидкости стандартам, т.е. соответствует ли жидкость рекомендациям,
- является ли жидкость всесезонной, т.е.обеспечит ли он оптимальную защиту системы охлаждения при любых погодных условиях,
- смешивается с другими жидкостями,
- произведено по новейшим технологиям и с использованием ингредиентов высочайшего качества.
Это самая важная информация, на которую мы должны обратить внимание при покупке подходящей жидкости для радиатора.
.