Электролит какая кислота
Перемешивается ли электролит в аккумуляторе при движении автомобиля? / Хабр
Привет, Хабр! Серная кислота почти вдвое тяжелее воды, и её водные растворы, в том числе аккумуляторный электролит, склонны к расслоению: тяжёлая кислота вытесняет лёгкую воду вверх и опускается вниз. Как это влияет на работу аккумуляторной батареи, и насколько эффективно перемешивает электролит тряска при движении транспортного средства? Проведём эксперимент с видео и показаниями приборов.
▍Перед началом опыта, вспомним известные факты о расслоении электролита:
❒ Основная токообразующая реакция в свинцовом аккумуляторе, — двойная сульфатация по Гладстону-Трайбу, — требует для заряда воды, которая расходуется из электролита с выделением кислоты, а при разряде наоборот, расходуется кислота и выделяется вода.
❒ Обязательными условиями заряда участка активной массы являются наличие в этом участке воды, а также электрический потенциал не ниже необходимого для преодоления термодинамической электродвижущей силы — ЭДС — на этом участке. ЭДС тем выше, чем выше концентрация кислоты.
❒ Следовательно, повышенная концентрация электролита в нижней части банок и глубине намазок пластин АКБ — аккумуляторной батареи — ведёт к тому, что для преодоления термодинамической ЭДС требуется более высокое напряжение на клеммах. При недостаточном напряжении заряд участка активной массы (АМ) с повышенной концентрацией кислоты не произойдёт никогда. Также препятствует заряду и недостаток воды в данном участке АМ.
❒ И заряд, и разряд активных масс ведут к расслоению электролита, так как выделяющаяся при заряде кислота стремится вниз, а образующаяся при разряде вода — вверх. Таким образом, если не предпринять специальных мер, при любой глубине циклирования или просто саморазряде АКБ расслоение электролита прогрессирует.
❒ Современные типы АКБ характеризуются плотными сепараторами, препятствующими оплыванию активных масс и короткому замыканию. Они повышают надёжность, виброустойчивость и срок службы АКБ, но и препятствуют перемешиванию электролита, усугубляя тенденцию к расслоению.
❒ Чем более прогрессирует расслоение электролита, тем большая доля активных масс при штатном зарядном напряжении не заряжается, то есть, остаётся в виде сульфата свинца, склонного переходить в труднорастворимую форму. Это явление называется сульфатацией. Не следует путать с двойной сульфатацией п. 1 — нормальной токообразующей реакцией. Сульфаты имеют меньшую плотность, чем заряженные АМ — губчатый свинец отрицательных пластин и оксид свинца положительных, потому сульфатированные намазки увеличиваются в объеме, что ведёт к разрушению конструкции аккумулятора и коротким замыканиям. П. 5 этому препятствует, но при отсутствии периодического выравнивающего заряда АКБ с расслоением и сульфатацией теряет ёмкость, токоотдачу и концентрацию кислоты в верхних слоях электролита.
❒ Электролит с низкой концентрацией кислоты замерзает при более высокой («менее минусовой») температуре, потому расслоение электролита ведёт к выходу аккумулятора из строя в зимнее время.

По просторам Всемирной Паутины с давних времён гуляет множество мифов
о губительности «кипячения», — заряда с перенапряжением и выделением водорода и кислорода, пузырьки которых перемешивают электролит, для автомобильных АКБ. Многие руководствуются этими мифами при заряде АКБ и выборе для этого зарядных устройств — ЗУ.
Отчасти поэтому, во многих моделях ЗУ производители ограничивают напряжение на уровне, не допускающем «кипения» электролита, в других моделях предоставляют пользователю выбор максимальных напряжений заряда путём ступенчатого переключения или плавной регулировки, даже если ЗУ представляет собой не просто источник питания со стабилизацией тока и напряжения (СС/CV), а имеет алгоритмы автоматического управления напряжением и током согласно табличным значениям профиля или на основании измерения характеристик АКБ.
Водород, аэрозоль серной кислоты и сероводород, могущие выделяться при заряде аккумулятора, действительно опасны, потому заряжать следует в проветриваемом помещении, адекватно управлять током, напряжением и временем заряда, изучить и соблюдать технику безопасности.
В сегодняшнем эксперименте посмотрим, насколько перемешают электролит пара современных отечественных ЗУ, и насколько это требуется от ЗУ вообще, применительно к стартерной аккумуляторной батарее. Ведь она монтируется на автомобиле (мотоцикле, снегоходе, катере...), а тот испытывает ускорения и вибрации при движении. Некоторые авторы считают, что поездки перемешают электролит, потому в функции зарядного устройства это не входит. Давайте попробуем, и узнаем.

Подопытным будет аккумулятор
АКОМ +EFB 6СТ-60VL. Со времени предыдущего стационарного обслуживания он использовался на автомобиле 4 месяца. График работы владельца автомобиля — сутки через трое, каждая поездка занимала 20 минут. Стартер и сигнализация за трое суток простоя в каждом таком цикле расходовали примерно 3 ампер*часа.
Начнём с измерения параметров текущего состояния. И как всегда, в первую очередь вымоем корпус и зачистим клеммы.

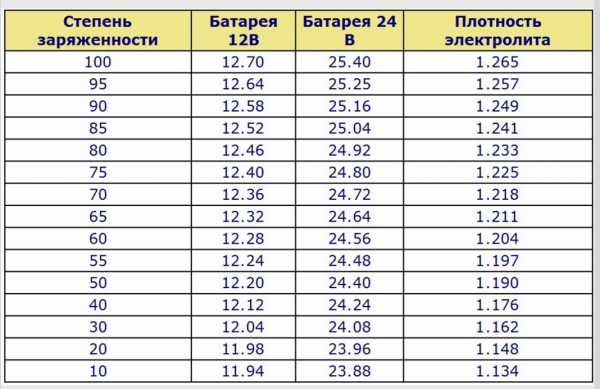
Напряжение разомкнутой цепи — НРЦ, оно же ЭДС без нагрузки, по показаниям трёх приборов 12.48, 12.50, 12.52 В.

Плотность электролита по банкам колеблется от 1.22 до 1.23. В крайних банках плотность ниже, в средних выше. Это тенденция, обычная для свинцовых батарей.
Итак, наблюдаем расхождение:
НРЦ соответствует уровню заряженности выше 80%, плотность электролита при котором должна быть 1.24, а по плотности уровень заряженности получается 75%, НРЦ должно быть 12.4 В. Причиной такого несоответствия как раз является расслоение электролита за 4 месяца эксплуатации под капотом. Повышенная концентрация кислоты в нижней части банок создаёт завышенное НРЦ. АКБ в таком состоянии необходим стационарный заряд.

Напряжение под нагрузочной вилкой не падает ниже 10 вольт, аккумулятор способен крутить стартер. Но если почитать инструкцию от производителя, то там чётко и ясно написано: если плотность ниже 1.25, аккумулятор требуется зарядить до плотности 1.28. Также в инструкции сказано, что можно оценить степень заряда по напряжению, и рекомендуется производить стационарный заряд при НРЦ ниже 12.5, но если имеется доступ к электролиту, то лучше проверить его плотность.

Приступаем к заряду зарядным устройством BL1204 на программе 2.

Заряд длился 9 часов. Плотность по банкам составила от 1.23 до 1.24.
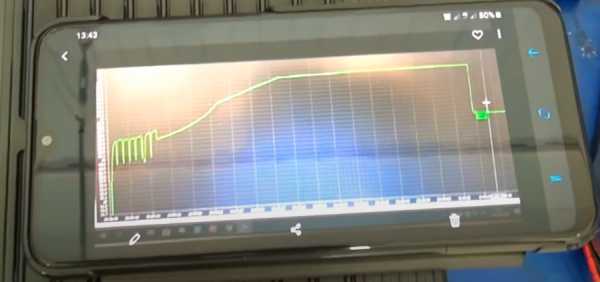
По графику напряжения на клеммах, видно, что ЗУ производит основной заряд с подачами и паузами разной продолжительности, а затем три этапа непрерывного дозаряда, после чего последовали тест АКБ и буферный режим 13.65 В. Однако для кальциевой АКБ до 14.8 вольт происходит лишь основной заряд, потому продолжим заряд на программе 4.
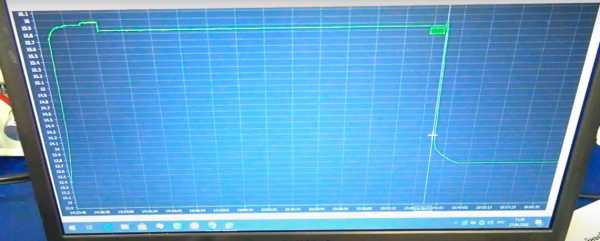
Время заряда составило 1 час 16 минут плюс 20 часов в режиме буферного хранения. Плотность поднялась ещё на одну сотую и составила от 1.24 до 1.25. Сделаем ещё один проход на 4-й программе.
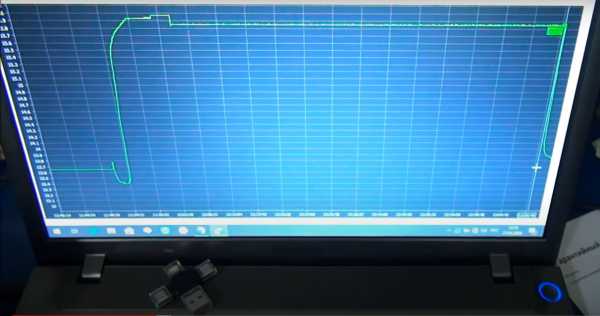
Время заряда снова 1 час 16 минут. Плотность поднялась всего на 0.005. Перезапустим программу 4 в третий раз.
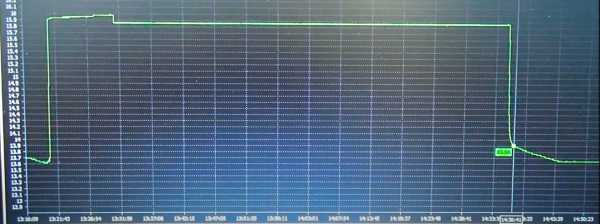
Третий проход длился те же 1 час 16 минут. Плотность снова поднялась на 0.005. Отключаем ЗУ от АКБ. После отстоя продолжительностью 18 часов 20 минут НРЦ 13.20 В. При плотности 1.25 это говорит об очень сильном расслоении электролита. Запустим программу 4 ещё раз.
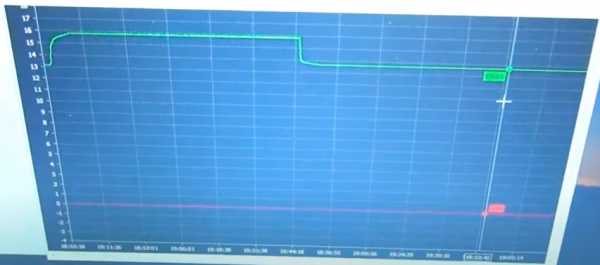
Заряд длился на этот раз около 50 минут. Плотность электролита не поднялась. Попробуем воспользоваться другим ЗУ.

Возьмём Бережок-V, установим 15.9 В — то же максимальное напряжение, что у BL1204.

Ток изменяется от -0.2 до 4.5 ампер. Отрицательное значение тока — не ошибка токовых клещей, а разрядные импульсы в асимметричном (реверсивном) заряде.
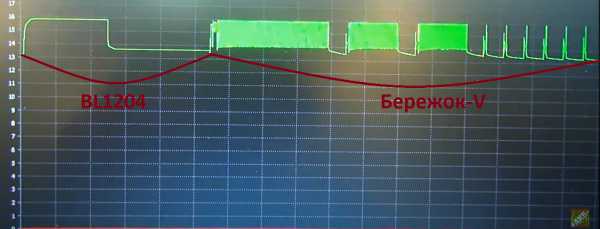
Заряд длился 4 часа, за которые ЗУ сделало две длительные паузы, и затем перешло в режим хранения — не поддержание буферного напряжения, как BL1204, а периодический подзаряд.
В пиках напряжение достигает тех же 15.9.
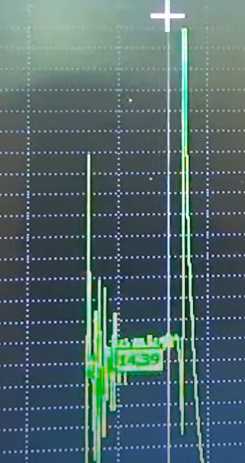
Плотность в 5 банках составила 1.26 или чуть выше, и в одной 1.255. Оставим АКБ на ночь дозаряжаться в режиме хранения.

По прошествии 15 часов, импульсы тока доходят до 5 А, снижаясь менее чем за секунду до 1 А.
Для отбора проб электролита из глубины банок воспользуемся удлинённой пипеткой, гибкий наконечник которой может пройти сбоку от пластин. Короткой пипеткой произведём отбор, как обычно, из верхнего слоя.

Плотность верхнего слоя составила 1.26, нижнего почти 1.31. Это весьма значительное расслоение, обуславливающее высокое напряжение разомкнутой цепи при недозаряженных и сульфатирующихся нижних частях пластин. Ни одно из применённых ЗУ при заряде нашего аккумулятора до 15.9В с расслоением не справилось.

Устранят ли поездки такое расслоение?
Для непосредственной проверки установим АКБ под капот, для чего пришлось удлинить провод массы.

Для лучшего перемешивания прибавим напряжение бортовой сети с 14.3 до 14.8 В, так как это позволяет сделать трёхуровневый регулятор напряжения.
Приборная панель Gamma GF-618 позволяет регистрировать данные поездок, что тоже очень пригодится в нашем эксперименте.
Пробег за трое суток в городском режиме составил 143.7 километра. Большое количество разгонов и торможений должно способствовать перемешиванию электролита.
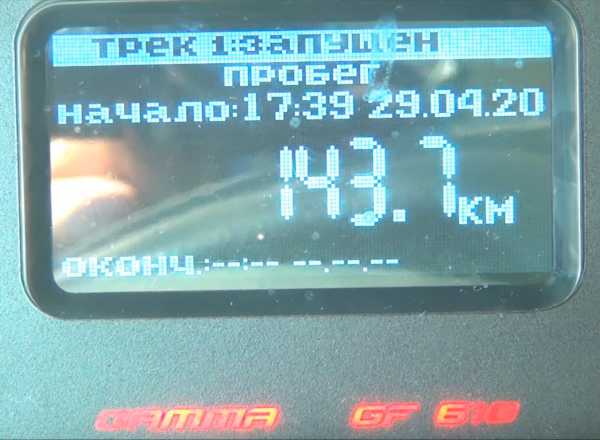
Израсходовано 12.8 литров бензина.
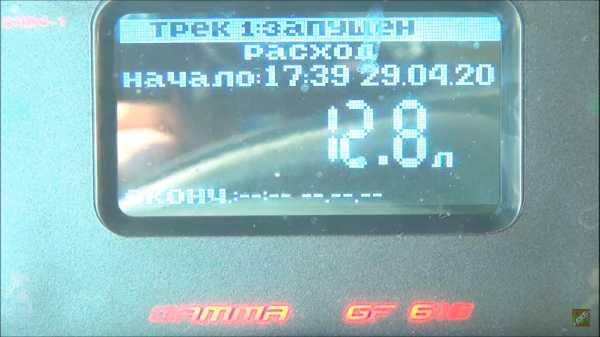
После таких поездок плотность на глубине составила 1.29.

Плотность сверху 1.27. Предписываемого инструкцией значения 1.28 так и не достигли. Расслоение до сих пор присутствует. Покатаемся ещё трое суток, на этот раз, не только по городу, но и по трассе.

Итого за 6 суток автомобиль двигался восемь с половиной часов.
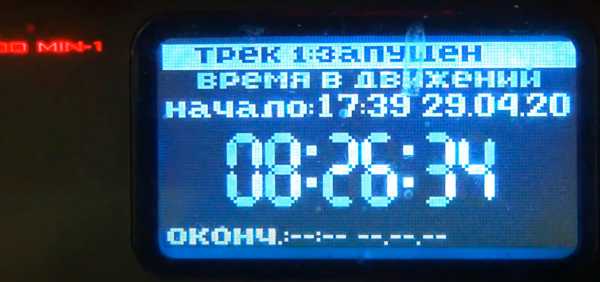
Общий пробег за это время 377.8 км.
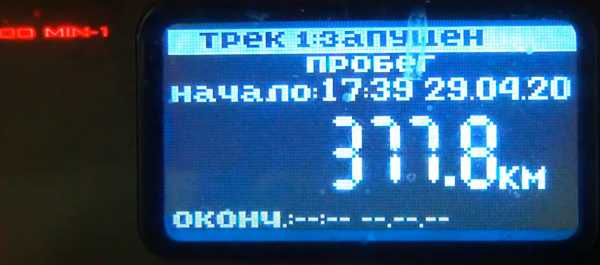
Бензина затрачено 28.8 литра.
Плотность электролита наверху и внизу, наконец, уравнялась, и составила чуть ниже 1.27.

Итак, чтобы устранить расслоение в Ca/Ca EFB аккумуляторе после нескольких перезапусков стационарного заряда до 15.9 вольт, понадобилось почти 378 километров пробега и 29 литров бензина при напряжении бортсети 14.8 В. Сделаем выводы:
Q: Перемешивается ли электролит в современном кальциевом аккумуляторе с высокой плотностью сепараторов и упаковки пластин при движении транспортного средства?
—
Да, действительно перемешивается.
Q: Насколько такое перемешивание эффективно?
— Мягко говоря,
не очень.При более низком напряжении бортовой сети и более коротких поездках расслоение электролита продолжило бы прогрессировать
Q: Остались ли после всех стараний в испытуемом аккумуляторе недозаряд и сульфатация?
—
Да, остались.Чтобы считать данную АКБ заряженной, мы должны получить плотность верхних слоёв не менее 1.28.
Q: Проявляют ли EFB аккумуляторы, вместе со склонностью к расслоению электролита, заявленную стойкость к длительному недозаряду (PSoC, partial state of charge, состояние частичной заряженности) и циклированию с глубокими разрядами?
—
Да,как показывают другие наши исследования, которые продолжаются, уже выложено несколько видео, и готовятся следующие видео и статьи.
Q: Тем не менее, будут ли ёмкость, токоотдача и устойчивость к замерзанию электролита деградировать если не предпринимать периодических регламентных процедур по полному стационарному заряду?
—
Будут,у любого свинцово-кислотного аккумулятора, потому что препятствует замерзанию концентрация кислоты в растворе, полезная ёмкость обеспечивается количеством заряженных (десульфатированных) активных масс, а способность отдавать ток полезной нагрузке и оперативно восполнять затраченную энергию от генератора автомобиля или иного зарядного устройства — действующей площадью активных масс. На ёмкость и токоотдачу влияет доступность воды для заряда и кислоты для разряда, т.е. расслоение электролита напрямую вредит этим ключевым для химического источника тока параметрам.
Теперь давайте всё-таки продолжим заряд данной аккумуляторной батареи. На этот раз начнёт Бережок-V, при том же напряжении окончания заряда 15.9 В.
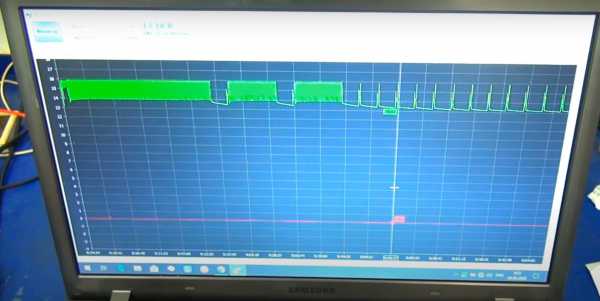
Заряд продолжался около 4 часов, плюс 4 часа в хранении.

Плотность поднялась с чуть ниже 1.27 до 1.275. Передаём эстафетную палочку BL1204.
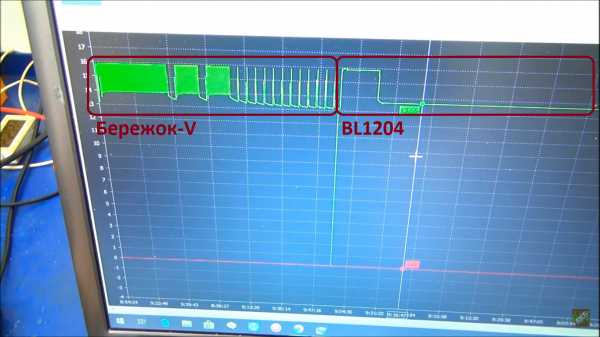
Заряд длился около часа, и далее 14 часов в режиме хранения.

Плотность осталась 1.275.

Установим на Бережке-V ограничение напряжения 16.7 вольт и запустим заряд.
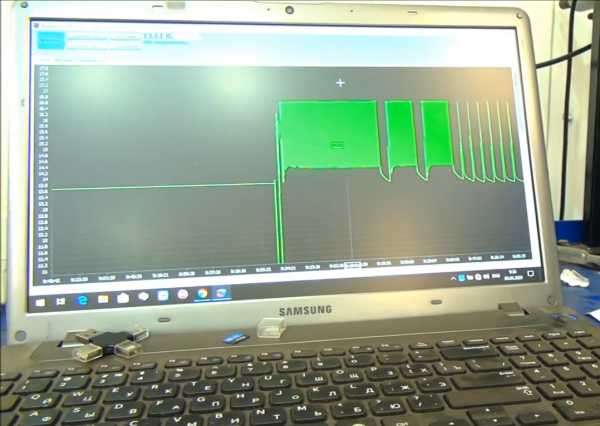
По прошествии 4 часов ЗУ автоматически перешло в режим хранения. Плотность и над пластинами, и на глубине чуть выше 1.28. Электролит перемешан, расслоение устранено.

Адекватный стационарный заряд не только перемешивает электролит эффективнее, чем ускорения и вибрации при движении транспортного средства, но и позволяет более полно зарядить аккумуляторную батарею, устранить сульфатацию, поднять эксплуатационные характеристики.

Спустя сутки, имеем следующие показания тестера:
Здоровье
100%, внутреннее сопротивление
4.81 мОм, ток холодной прокрутки
574 из 560 Апо стандарту EN. НРЦ 12.80 В соответствует плотности
1.28. Расслоения нет, АКБ в
полном порядке, можно ставить под капот.
Статья составлена в сотрудничестве с аккумуляторщиком Виктором VECTOR, осуществившим описанные опыты.

Электролит свинцово-кислотной аккумуляторной батареи.
Электролит
Для работы свинцово-кислотной аккумуляторной батареи необходим электролит – водный раствор серной кислоты, обладающий высокой ионной проводимостью. При погружении электродов аккумулятора в электролит и подключении к выводам электродов внешней нагрузки начинаются электрохимические реакции, описанные в предыдущей статье.
Электролит для заливки в аккумуляторную батарею готовят из серной кислоты (ГОСТ 667-73) и дистиллированной воды (ГОСТ 6709-72). При подготовке электролита следует пользоваться руководством по эксплуатации автомобиля. Для надежной работы аккумуляторных батарей необходима высокая степень чистоты электролита.
Нельзя применять техническую серную кислоту и недистиллированную воду, так как при этом ускоряется саморазрядка, сульфатация и разрушение пластин, и уменьшается емкость батареи.
При приготовлении электролита кислоту льют тонкой струйкой в воду, одновременно помешивая раствор чистой стеклянной палочкой. Нельзя наливать воду в кислоту, так как при этом выделяется большое количество тепла в верхних слоях раствора, и электролит будет разбрызгиваться из емкости и при попадании на тело может вызвать ожоги.
Смешивать электролит следует в кислотостойкой эбонитовой, фарфоровой или освинцованной посуде.
Количество дистиллированной воды, серной кислоты или электролита при приготовлении 1 литра электролита необходимой плотности приведены в таблице 1.
Таблица 1. Количество дистиллированной воды, серной кислоты или электролита плотностью 1,4 г/см3 для приготовления 1 л электролита необходимой плотности при температуре 25 ˚С, л
Плотность |
Для серной кислоты |
Для электролита |
||
дистиллированная |
серная кислота |
дистиллированная |
электролит |
|
1,23 |
0,829 |
0,231 |
0,465 |
0,549 |
1,25 |
0,809 |
0,253 |
0,410 |
0,601 |
1,27 |
0,791 |
0,274 |
0,357 |
0,652 |
1,31 |
0,749 |
0,319 |
0,246 |
0,760 |
1,40 |
0,650 |
0,423 |
0 |
1 |
Плотность электролита определяют с помощью денсиметра или ареометра.
Новые аккумуляторные батареи заливают электролитом плотностью на 0,02 г/см3 меньше той, которая должна быть в конце зарядки.
***
Плотность электролита
Плотность электролита, как и любого другого вещества, определяется отношением массы к занимаемому этой массой объему. Для электролита плотность измеряется в граммах на кубический сантиметр (г/см3).
Поскольку плотность дистиллированной воды равна 1 г/см3, а серная кислота тяжелее воды (ее плотность при +20 ˚С составляет: 1,8312-1,8355 г/см3), то с добавлением серной кислоты в воду плотность электролита будет возрастать, а при добавлении в раствор (электролит) воды, его плотность будет уменьшаться. По этим же причинам плотность будет уменьшаться при сульфатации пластин и при сильной разрядке батареи, а увеличивается при испарении воды (например, в процессе интенсивной зарядки).
При понижении плотности электролита возрастает внутреннее сопротивление аккумуляторной батареи и уменьшается ее емкость. В морозное время года чрезмерное снижение плотности может привести к замерзанию электролита.
Повышение плотности электролита приводит к интенсивному разрушению пластин и их сульфатации, что снижает емкость аккумулятора и уменьшает срок его службы. Следует учитывать, что плотность электролита в аккумуляторах (банках) аккумуляторной батареи не должна отличаться более чем на 0,01 г/см3. В противном случае батарею необходимо полностью зарядить и произвести корректирование плотности электролита.
Если плотность выше нормы - доливают дистиллированную воду, если ниже - электролит плотностью 1,4 г/см3 (электролит можно доливать лишь в полностью заряженную аккумуляторную батарею). Корректировку плотности доливкой производят после предварительного отбора из аккумуляторов нужного количества электролита. После этого аккумуляторную батарею заряжают в течение 25...30 мин для полного перемешивания электролита и снова измеряют его плотность.
В процессе эксплуатации необходимо следить за состоянием аккумуляторной батареи. При нормальных эксплуатационных параметрах плотность электролита в аккумуляторах батареи является индикатором степени их разрядки. Снижение плотности электролита на 0,01 г/см3 соответствует разрядке аккумулятора на 6 %.
Если появляется необходимость в частой подзарядке батареи, следует выяснить причину и ее устранить, поскольку систематическая недозарядка аккумуляторной батареи значительной сокращает срок ее службы и отрицательно сказывается на пусковых качествах двигателя.
***
Определение степени зарядки аккумуляторной батареи
Степень зарядки аккумуляторной батареи проверяют измерением плотности электролита, приведенной к температуре +25 ˚С. В зависимости от климатических условий эксплуатации автомобиля и времени года используется электролит разной плотности (таблица 2).
Таблица 2. Плотность электролита в зависимости от климатических условий и времени года
Макрокли- |
Климатический район (ГОСТ 16350-80) |
Средне- |
Время года |
Плотность электролита приведенная к температуре +25 ˚С, г/см3 |
|
Для новой аккумуляторной батареи |
Для заряженной аккумуляторной батареи |
||||
Холодный |
Очень холодный |
от -50 до -30 |
Зима |
1,28 |
1,30 |
Лето |
1,24 |
1,26 |
|||
Холодный |
от -30 до -15 |
Круглый год |
1,26 |
1,28 |
|
Умеренный |
Умеренный |
от -15 до -3 |
Круглый год |
1,24 |
1,26 |
Жаркий сухой |
от -15 до +4 |
1,22 |
1,24 |
||
Теплый влажный |
0 до +4 |
1,20 |
1,22 |
||
При определении плотности электролита необходимо учитывать его температуру, применяя соответствующие поправки, приведенные в таблице 3.
Таблица 3. Поправки при измерении плотности электролита (г/см3) в зависимости от его температуры
Температура электролита, |
+45 |
+30 |
+15 |
0 |
-30 |
-15 |
-45 |
Поправка плотности |
+0,02 |
+0,01 |
0 |
-0,01 |
-0,02 |
-0,03 |
-0,04 |
***
Проверка уровня электролита
Одним из важнейших условий надежной работы аккумуляторной батареи является поддержание необходимого уровня электролита в ее элементах. Уровень электролита в каждой секции моноблока (банках) должен быть на 10…15 мм выше предохранительного щитка, установленного над сепараторами.
Для облегчения контроля уровня электролита у заливных горловин аккумуляторных батарей снизу имеются указатели – тубусы, входящие внутрь аккумуляторной батареи. Нижний срез тубуса находится на требуемом расстоянии от поверхности предохранительного щитка. Уровень электролита считается достаточным, если поверхность электролита касается нижнего торца тубуса горловины. При этом на поверхности электролита образуется четко видимый мениск. Если уровень электролита ниже указанного из-за выплескивания, следует долить дистиллированной воды.
Проверять уровень электролита рекомендуется на остывшей заряженной аккумуляторной батарее или после длительной поездки, так как в этом случае происходит «кипение» электролита, повышение его температуры и испарение дистиллированной воды.
В случае превышения уровня электролита в банках аккумуляторной батареи его следует уменьшить с помощью резиновой груши, так как выплескивание может привести к интенсивной коррозии деталей крепления и к окислению проводов.
***
Типы автомобильных аккумуляторов
Главная страница
Дистанционное образование
Специальности
Учебные дисциплины
Олимпиады и тесты
Серная кислота аккумуляторная
Описание:Серная кислота - бесцветная маслянистая жидкость, не имеющая запаха. С водой и серным ангидридом смешивается в любых соотношениях с выделением большого количества тепла. Контактная серная кислота с массовой долей моногидрата 92,5-94,0% является водным раствором моногидрата (100% серной кислоты). В технике под серной кислотой подразумевают любые соединения H2SO4 с водой. Водные растворы серной кислоты характеризуются массовой долей в них H2SO4 или SO3
Серная кислота - одна из самых активных неорганических кислот. Она реагирует почти со всеми металлами и их оксидами, вступает в реакции обмена, обладает окислительными и другими важными свойствами. Основные физико-химические свойства растворов серной кислоты зависят от соотношения в ней воды и серного ангидрида (триоксида серы).
Применение:Серная кислота используется в производстве минеральных удобрений, красителей, химических волокон, а также в металлургии. Она применяется для различных технологических целей в текстильной, пищевой и др. отраслях промышленности. Аккумуляторная серная кислота применяется после разбавления ее дистиллированной водой в качестве электролита для заливки свинцовых аккумуляторов.
В качестве электролита для аккумуляторных батарей применяют раствор серной аккумуляторной кислоты в дистиллированной воде. Для различных климатических и температурных условий, в которых батарее предстоит работать, используют электролит различной плотности. Плотность электролита зависит от концентрации раствора серной аккумуляторной кислоты -- чем больше концентрация раствора, тем больше плотность электролита и от температуры раствора -- чем выше температура, тем ниже плотность. Концентрация или плотность электролита является точным критерием степени разряженности аккумулятора. В качестве точки отсчета, для определения текущей степени разряженности аккумулятора, принимается нормативная плотность электролита, т.е. плотность, приобретенная после первого полого заряда. Для свинцовых аккумуляторов характерно сильное разбавление электролита во время разряда из-за участия в реакции серной аккумуляторной кислоты с образованием воды. В заряженных аккумуляторах концентрация кислоты равна 30...40%. Чем меньше объем электролита, в сравнении с массой электродов, тем быстрее снижается концентрация кислоты при разряде. В конце разряда она составляет от 10 до 25%.
Серная кислота
ГОСТ 667-73
Влияние суперпластификатора и ускорителя набора прочности ПФМ-НЛК на подвижность бетонной смеси и прочностные характеристики бетона
| Технические характеристики | Высший сорт | Первый сорт |
|---|---|---|
| Массовая доля моногидрата (H2SO4), % | 92-94 | 92-94 |
| Массовая доля железа (Fe), % | 0,005 | 0,01 |
| Массовая доля остатка после прокаливания, %, не более | 0,02 | 0,03 |
| Массовая доля оксидов азота (N2O4), %, не более | 0,00003 | 0,00001 |
| Массовая доля мышьяка (As), %, не более | 0,00005 | 0,00008 |
| Массовая доля хлористых соединений (Cl), %, не более | 0,0002 | 0,0003 |
| Массовая доля марганца (Mn), %, не более | 0,00005 | 0,0001 |
| Массовая доля суммы тяжелых металлов в пересчете на свинец (Pb), %, не более | 0,01 | 0,01 |
| Массовая доля меди (Cu), %, не более | 0,0005 | 0,0005 |
| Массовая доля веществ, восстанавливающих KMnO4, см3 раствора с (1/5 KMnO4) = 0,01 моль/дм3, не более | 4,5 | 7 |
| Прозрачность | Должна выдерживать испытание по п. 3.13 | |
Серная кислота упаковывается в ж/д и авто цистерны, канистры, кубовые емкости.
Хранение:Техническая серная кислота и олеум (концентрированная серная кислота) должны храниться в емкостях из стали или спецстали, как нефутерованных, так и футерованных кислотоупорным кирпичом или кислотоустойчивым материалом.
Транспортировка:
Серную кислоту техническую транспортируют в железнодорожных сернокислотных цистернах в соответствии с правилами перевозок грузов. На цистерны должны быть нанесены специальные трафареты в соответствии с правилами перевозок грузов, действующими на ж.д. транспорте.
Кислота серная пожаро- и взрывобезопасна, при соприкосновении ее с водой происходит бурная реакция с большим выделением тепла, паров и газов. Токсична. По степени воздействия на организм относится к веществам 2-го класса опасности. При работе с серной кислотой обязательно применять спецодежду.
Серная кислота аккумуляторная
Серная кислота аккумуляторная
- ГОСТ 667-73
- Химическая формула: h3SO4
- Описание Серная кислота аккумуляторная : Серная кислота - бесцветная маслянистая жидкость, не имеющая запаха. С водой и серным ангидридом смешивается в любых соотношениях с выделением большого количества тепла. Контактная серная кислота с массовой долей моногидрата 92,5-94,0% является водным раствором моногидрата (100% серной кислоты). В технике под серной кислотой подразумевают любые соединения h3SO4 с водой. Водные растворы серной кислоты характеризуются массовой долей в них h3SO4 или SO3. Серная кислота - одна из самых активных неорганических кислот. Она реагирует почти со всеми металлами и их оксидами, вступает в реакции обмена, обладает окислительными и другими важными свойствами. Основные физико-химические свойства растворов серной кислоты зависят от соотношения в ней воды и серного ангидрида (триоксида серы).
Применение Серная кислота аккумуляторная : Серная кислота используется в производстве минеральных удобрений, красителей, химических волокон, а также в металлургии. Она применяется для различных технологических целей в текстильной, пищевой и др. отраслях промышленности. Аккумуляторная серная кислота применяется после разбавления ее дистиллированной водой в качестве электролита для заливки свинцовых аккумуляторов. В качестве электролита для аккумуляторных батарей применяют раствор серной аккумуляторной кислоты в дистиллированной воде. Для различных климатических и температурных условий, в которых батарее предстоит работать, используют электролит различной плотности. Плотность электролита зависит от концентрации раствора серной аккумуляторной кислоты -- чем больше концентрация раствора, тем больше плотность электролита и от температуры раствора -- чем выше температура, тем ниже плотность. Концентрация или плотность электролита является точным критерием степени разряженности аккумулятора. В качестве точки отсчета, для определения текущей степени разряженности аккумулятора, принимается нормативная плотность электролита, т.е. плотность, приобретенная после первого полного заряда. Для свинцовых аккумуляторов характерно сильное разбавление электролита во время разряда из-за участия в реакции серной аккумуляторной кислоты с образованием воды. В заряженных аккумуляторах концентрация кислоты равна 30...40%. Чем меньше объем электролита, в сравнении с массой электродов, тем быстрее снижается концентрация кислоты при разряде. В конце разряда она составляет от 10 до 25%.
Транспортирование Серная кислота аккумуляторная : Серную кислоту техническую транспортируют в железнодорожных сернокислотных цистернах в соответствии с правилами перевозок грузов. На цистерны должны быть нанесены специальные трафареты в соответствии с правилами перевозок грузов, действующими на ж.д. транспорте.
Упаковка Серная кислота аккумуляторная : Информация отсутствует.
Хранение Серная кислота аккумуляторная : Техническая серная кислота и олеум (концентрированная серная кислота) должны храниться в емкостях из стали или спецстали, как нефутерованных, так и футерованных кислотоупорным кирпичом или кислотоустойчивым материалом.
Безопасность Серная кислота аккумуляторная : Кислота серная пожаро- и взрывобезопасна, при соприкосновении ее с водой происходит бурная реакция с большим выделением тепла, паров и газов. Токсична. По степени воздействия на организм относится к веществам 2-го класса опасности. При работе с серной кислотой обязательно применять спецодежду.
Цена Серная кислота аккумуляторная : Низкая стоимость, а также скидки в зависимости от объема закупаемого товара.
Оформление и отгрузка Серная кислота аккумуляторная : Благодаря отлаженной работе офиса и складов, мы предоставляем быстрое оформление и отгрузку товаров.
Доставка Серная кислота аккумуляторная : Мы предлагаем доставку товаров по России:
- автотранспортом;
- железнодорожными контейнерами, вагонами;
- через транспортные компании.
Для получения подробной информации о ценах на товары и условиях поставки звоните нашим специалистам по телефонам: (383) 279-12-43, 279-17-37, 279-16-30.
Также вы можете купить Серная кислота аккумуляторная через интернет-магазин компании ОАО Реактив:
Электролит и химические процессы в свинцовых аккумуляторах
Электролит. Свинцовые аккумуляторы заливают электролитом, который состоит из аккумуляторной серной кислоты и дистиллированной воды. Аккумуляторная серная кислота - тяжелая прозрачная маслянистая жидкость, хорошо растворяется в воде, без запаха, разъедает кожу, бумагу, материю. Для приготовления электролита применяют три сорта серной кислоты: с государственным Знаком качества, 1-го сорта и 2-го сорта. В серной кислоте 1-го и 2-го сорта до допустимых пределов снижено число примесей (железа, окислов азота, мышьяка, марганца и др.). Аккумуляторная серная кислота поступает с заводов в стеклянных бутылях со стеклянными притертыми пробками, навинчивающимися полиэтиленовыми или пластмассовыми крышками. Бутыли устанавливают в ивовые корзины, полиэтиленовые или деревянные обрешетки. Их должны переносить два работника при строгом соблюдении правил техники безопасности.
Дистиллированная вода отличается от водопроводной или речной почти полным отсутствием примесей (солей, сульфатов, хлоридов и др ). Такую воду получают при помощи перегонных кубов - дистилляторов.
Электролит готовят в чистой кислотостойкой посуде (эбонитовой, керамической, фаянсовой). Часто используют деревянные баки, внутри выложенные листовым свинцом. Нельзя пользоваться стеклянной посудой: при растворении серной кислоты выделяется большое количество тепла и стеклянные сосуды, нагреваясь, могут лопнуть.
В сосуд наливают дистиллированную воду, а затем тонкой струей серную кислоту, перемешивая этот раствор палочкой из стекла или эбонита Так как серная кислота тяжелее воды, то выделяющееся при растворении тепло равномерно распределяется по всему объему электролита. Запрещается вливать воду в кислоту. В этом случае струя воды, соприкасаясь только с поверхностными слоями кислоты, быстро нагревается и разбрызгивается вместе с частицами серной кислоты Эти брызги, попадая на кожу, могут причинить серьезные ожоги. При приготовлении электролита необходимо надевать защитные очки, резиновые перчатки и фартук, суконный комбинезон и галоши. Для нейтрализации серной кислоты и электролита, попавших на кожу или одежду, необходимо всегда иметь 5-10%-ный раствор соды или 5-10%-ный раствор нашатырного спирта. Если серная кислота попала на кожу, то ее следует сразу смочить защитным раствором, а затем несколько раз промыть водой. Плотность электролита измеряют ареометром (рис 211, а) Он представляет собой стеклянную трубку 4, запаянную с обеих сторон, в нижней части которой находится грузик, а в верхней - шкала Ареометр Л, опущенный в мензурку 1 с электролитом 2, занимает вертикальное положение, причем некоторая часть его выступает наружу Глубина погружения ареометра зависит от плотности электролита:

чем больше плотность электролита, тем меньше погружается ареометр По делению шкалы, которое находится на уровне раствора, определяют плотность электролита Аккумуляторный ареометр (рис 211, б) помещается в стеклянную трубку 4, на один конец которой надета резиновая груша 5, а на другой -трубчатый наконечник 6 из кислотостойкого материала При помощи резиновой груши электролит всасывают в стеклянную трубку с ареометром. Для заполнения новых стационарных свинцовых аккумуляторов применяют электролит плотностью 1,18 г см3 при температуре 25 С С повышением плотности электролита от 1,18 до 1,29 гем3 снижается температура его замерзания Например, электролит плотностью 1,29 г/см3 замерзает при температуре -74 С Поэтому переносные аккумуляторы, работающие при низких температурах, заливают электролитом повышенной плотности Например, в центральных районах при температуре зимой до -ЗО С в стартерные аккумуляторы заливают электролит плотностью 1,27 г/см3 Аккумуляторы типов АБН-72 и АБН-80 заливают электролитом плотностью 1,21 г ем3 Перед заливкой в аккумуляторы электролит необходим/) охладить до температуры 25 С Для того чтобы уменьшить время охлаждения, рекомендуется ступенчатое приготовление электролита: из кислоты плотностью 1,83 г ем3 приготовить электролит плотностью 1,4 гем3, а из,него - - электролит плотностью 1,18-1,3 г см3
Химические процессы. У заряженного свинцового аккумулятора активная масса положительных пластин состоит из двуокиси свинца РЬ02, а отрицательных - из губчатого свинца РЬ Двуокись свинца имеет темно-коричневый цвет, а губчатый свинец - светло-серый Пластины погружены в электролит - водный раствор серной кислоты В результате электролитической диссоциации молекулы серной кислоты электролита распадаются на положительные ионы водорода и отрицательные ионы кислотного остатка
К заряженному аккумулятору присоединим приемник энергии сопротивлением г (рис 212, а) и рассмотрим химические процессы в аккумуляторе при его разряде Разрядный ток 1,, направлен от положительной пластины через приемник энергии г к отрицательным пластинам, а затем через электролит - от отрицательных пластин к положительной
В электролите положительные ионы водорода 2Н+ перемещаются по направлению тока, а отрицательные ионы БОГ- - против В результате разряда в свинцовом аккумуляторе происходят химические реакции
РЬО*, : РЬ* 2Н,,Ч04 ¦ РЬЯ04 РЬ.чЬ,, 21!.,().
Из уравнения видно, что в процессе разряда двуокись свица РЬО., на положительных пластинах и губчатый свинец РЬ на отрицательных пластинах превращаются в сернокислый свинец РЬЯО+ Эти химические реакции идут с поглощением серной кислоты, поэтому в про цессе разряда плотность электролита снижается. При глубоком разряде сернокислый свинец превращается в твердую крупнокристаллическую соль, которая плохо восстанавливается во время заряда. Поэтому аккумуляторы разряжают только до определенной плотности электролита. Для стационарных аккумуляторов она равна 1,17- 1,15 г/см3. Для заряда через аккумуляторы пропускают постоянный ток, направленный противоположно разрядному току. Для этого аккумулятор подключают к выпрямителю В (рис. 212, б) или другому источнику постоянного тока. Положительный зажим выпрямителя соединяют с блоком положительных пластин, а отрицательный - с блоком отрицательных пластин.
Зарядный ток 13 направлен внутри электролита от положительных пластин к отрицательным. Поэтому к положительным пластинам подходят отрицательные ионы кислотного остатка , а к отрицательным пластинам - положительные ионы водорода 2Н+.
Химические реакции при заряде можно представить следующим уравнением: Р1эбЬ4 + РЬ5Ю4 + 2Н20 РЬ(02 + 4- 2Н2804.
Во время заряда сернокислый свинец РЬБ04 превращается в двуокись свинца РЬ02 на положительных пластинах и в губчатый свинец РЬ на отрицательных пластинах. Одновременно увеличивается количество серной кислоты в растворе, что повышает плотность электролита до тех пор, пока весь сульфат свинца не преобразуется в активные вещества, которые были в аккумуляторе перед разрядом. Поэтому плотность электролита в конце заряда равна плотности электролита в начале разряда. У стационарных аккумуляторов плотность электролита в конце заряда достигает 1,2-1,21 г/см3; у аккумуляторов типа АБН плотность электролита достигает 1,18-1,2 г/см3 летом и 1,3-1,32 г/см3 зимой. После восстановления активных масс на пластинах зарядный ток разлагает воду электролита на водород и кислород, которые, смешиваясь, образуют взрывоопасную смесь,

Рис. 212. Простейший свинцовый аккумулятор (а) и схема его заряда (б)
называемую гремучим газом. Разложение воды электрическим током обнаруживается по интенсивному выделению пузырьков водорода и кислорода на поверхности электролита («кипению»).
⇐Свинцовые аккумуляторы | Электропитающие устройства и линейные сооружения автоматики, телемеханики и связи железнодорожного транспорта | Электрические характеристики свинцовых аккумуляторов⇒
Нужно ли доливать электролит в аккумулятор? - Иксора
Аккумуляторный электролит - это жидкое вещество, которое содержится в большинстве автомобильных аккумуляторов. Иногда его называют аккумуляторной кислотой, потому что он имеет кислотную базу. Фактически, электролит батареи состоит из смеси воды и серной кислоты.
Когда уровень электролита в вашей АКБ становится низким, вы можете задаться вопросом, чем нужно пополнить его объем. Некоторые автовладельцы ошибочно считают, что в экстренной ситуации аккумулятор можно заполнить соленой водой, пищевой содой или каким-либо другим видом электролита. Наш ответ – нет. Никогда не добавляйте какой-либо электролит в свинцово-кислотный автомобильный аккумулятор.
Если вы обнаружили низкий уровень электролита в своем АКБ, вам следует добавить только чистую воду. И только при некоторых, очень специфических обстоятельствах, в батарею можно добавить серную кислоту. Например, если аккумулятор опрокинулся и протек.
Что означает низкий уровень электролита в батарее?
Когда ваш механик или друг, который много знает об автомобилях, говорит вам, что у вас низкий уровень электролита, это означает, что уровень жидкости в одном или нескольких элементах батареи упал ниже верха свинцовых пластин. Рассмотрим эту ситуацию подробнее.
Автомобильные аккумуляторы состоят из ряда свинцовых пластин, погруженных в своеобразную ванну с водой и серной кислотой, которая действует как электролит. Очень важно, чтобы уровень жидкости никогда не опускался ниже верха пластин. Если электролит в аккумуляторе падает ниже этого уровня, пластины подвергаются воздействию воздуха, начинается химический процесс, называемый сульфатированием (сульфатацией). Этот процесс может значительно сократить срок службы батареи, поскольку он мешает нормальной работе ее элементов. При этом серная кислота в электролите поглощается свинцовыми пластинами при разрядке батареи, а затем высвобождается обратно в электролит, когда батарея заряжается.
Почему в АКБ можно добавлять только чистую воду?
Добавление в батарею чего-либо, кроме воды, может мгновенно нанести ей повреждения. Например, пищевая сода может нейтрализовать серную кислоту, присутствующую в электролите батареи.
Очевидно, что вода сама по себе не является электролитом, поэтому добавление только воды в батарею на первый взгляд может показаться плохой идеей. Электролит – смесь из воды и серной кислоты, поэтому более логичным кажется долить в батарею серную кислоту, помимо обычной воды. Однако, причина, по которой в батарею нужно добавлять только воду заключается в том, что, когда свинцово-кислотная батарея теряет воду, она не теряет серную кислоту. Вода естественным образом исчезает в процессе электролиза в результате испарения, особенно в жаркую погоду, в то время как серная кислота никуда не денется, или ее объем будет теряться с гораздо меньшей скоростью.
Простой способ понять, как это работает, - вспомнить о том, что происходит, когда вы кипятите кастрюлю с соленой водой. Вода испаряется, но соль остается. Если вы добавите в кастрюлю обычную воду, она смешается с солью, и у вас снова будет соленая вода. То же самое происходит, когда вы добавляете дистиллированную воду в свинцово-кислотную батарею. Единственное исключение - если уровень жидкости низкий из-за опрокидывания аккумулятора. Когда это происходит, весь раствор серной кислоты и воды вытекает. В этом случае вам необходимо заполнить пустые элементы разбавленной смесью воды и серной кислоты.
Все необходимые автозапчасти можно приобрести в магазине IXORA, а подобрать подходящую деталь могут профессиональные менеджеры.
* Применяемость деталей конкретно для Вашего автомобиля уточняйте у менеджеров по телефону: 8 800 555-43-85 (звонок по России бесплатный).
Полезная информация:
Получить профессиональную консультацию при подборе товара и подробную информацию по всем интересующим Вас вопросам можно позвонив по телефону - 8 800 555-43-85 (звонок по России бесплатный).
Что представляет собой электролит и насколько он опасен
Электролит в автомобильных аккумуляторах, представленных в продаже, - та среда, в которой происходят химические реакции, в результате которой происходит накопление и отдача электроэнергии для питания электрооборудования транспортного средства при выключенном двигателе.
Электролит, присутствующий в автомобильных и мотоаккумуляторах, представлен разбавленной серной кислотой. Это – агрессивная химическая среда, требующая осторожного обращения. Попадание брызг электролита на кожу или в глаза вызывает очень болезненные ощущения и ожоги. Вылечить их трудно.
Свинцово-кислотный АКБ — один из самых распространенных типов аккумуляторных батарей, использующийся как источник электроэнергии в автомобилях, мотоциклах, мопедах и прочих ТС. Необходимость купить автомобильные аккумуляторы этого типа возникает у большинства авто-мото-любителей. Вот почему с электролитом приходится иметь дело многим владельцам транспортных средств.
Меры предосторожности при обращении с электролитом:
- Серная кислота (h3SO4) – ядовитое вещество, поэтому, работая с АКБ, обязательно надевайте специальные очки, резиновые перчатки и фартук. Они защитят от ожогов, порчи кузова машины, мотоцикла и т.д., одежды.
- На этот случай всегда имейте под рукой нейтрализующие аккумуляторную кислоту средства – раствор нашатырного спирта или соду. При попадании электролита на тело и проч. сразу же нейтрализуйте ее действие, потом смойте струей воды. При попадании в глаза промывайте их не менее четверти часа, после чего сразу же обращайтесь к врачу.
- Если Вы предпочитаете не покупку готового электролита для АКБ своего автомобиля или мототехники, а готовите самостоятельно, то советуем вливать концентрированную h3SO4 в воду тонкой струей (только в не металлическую емкость), постоянно помешивая раствор. Поступать наоборот - вливать воду в кислоту - недопустимо. В этом случае в результате выделяемого при смешивании тепла образуются капельки кислоты, которые начинают брызгать в разные стороны.
- При постановке свинцово-кислотных автоаккумуляторов на зарядку, не закручивайте пробки заливочных емкостей. Дайте образующимся в процессе зарядки батареи газам свободный выход иначе корпус АКБ взорвется.
- При постановке кислотных обслуживаемых аккумуляторов обязательно выкручиваются пробки заливочных отверстий для свободного выхода образующихся в процессе зарядки газов. В противном случае скопившийся в корпусе водород взорвет аккумулятор.
Выбирая автомобильный аккумулятор в Балашихе или Реутове, можно остановиться на современной необслуживаемой модели. Если же Вы предпочитаете обслуживаемую АКБ, то при работе с ней не пренебрегайте общими мерами предосторожности.
Поблизости от заряжающейся батареи нельзя допускать открытого огня, искр (проводить сварные работы, например), короткого замыкания, курить. Помещение, где происходит зарядка, должно хорошо проветриваться. Если есть необходимость в проверке токопроводящих кабелей автомобиля, то обесточьте электрическую систему и не включайте зажигание. Присоединяя и отсоединяя провода зарядного устройства к АКБ, тоже сначала обесточьте его. И последняя предосторожность, которую нужно строго соблюдать автолюбителю: первым при отключении автоаккумулятора отсоединяйте провод массы, а при подключении он подсоединяется последним.
роль, норм, нехватка. Как восполнить электролиты?
Электролитами, необходимыми организму, являются ионы солей: натрия, калия, кальция и магния, кроме того, важны ионы железа, хлора и фосфата (анионы, присутствующие в организме, важны для регуляции кислотно-щелочного баланса, поддерживают образование соляной кислоты в желудке). . Они являются сильными электролитами, т.е. полностью растворимы в жидкостях.Мы обеспечиваем их организм водой, другими жидкостями и пищей. Натрий входит в состав соли. Калий содержится в помидорах, картофеле, бананах, авокадо, киви, грейпфрутах, кураге и инжире. Мы поставляем кальций с молоком и его продуктами, с сардинами, бобовыми и хлебом из непросеянной муки. Магний содержится в какао, шоколаде, фундуке, овсянке и гречке. Также попробуйте N°1 Magnesium Mg — пищевую добавку с магнием, восстанавливающую электролитный баланс в организме.
Водный баланс организма зависит от наличия электролитов. Поскольку они заряжены положительно или отрицательно, они притягивают молекулы воды, которые распределяются по всему телу. Кроме того, электролиты обеспечивают проведение нервных импульсов, необходимых для функционирования мозга и нервной системы. Они также необходимы мышцам, в том числе сердечной, так как влияют на их работу (сокращения и расслабления).
Кроме того, электролиты отвечают за поддержание правильного уровня pH в нашем организме. Шкала рН является мерой кислого или щелочного раствора. В нашем организме он регулируется химическими буферами или слабыми кислотами и основаниями, которые помогают минимизировать изменения во внутренней среде. Наша кровь регулируется от 7,35 до 7,45. Если оно отклоняется от этого, организм не может функционировать должным образом, и мы чувствуем себя плохо.
Последствия нехватки:
- мышечный тремор и судороги,
- припухлость
- диарея или запор
- сонливость, упадок сил, недомогание,
- мышечные боли,
- снижение мышечной силы,
- слабость,
- отсутствие аппетита
- головокружение,
- тошнота.
В более серьезных случаях также: обморок, судороги, проблемы с сердцем (аритмия), высокое кровяное давление, хрупкие кости и даже паралич.
Электролиты особенно важны для детей. Их дефицит быстро приводит к обезвоживанию.
Также во время беременности стоит проверить уровень электролитов в организме. В пакете "Тесты на беременность - анализ крови" вы найдете и другие параметры, важные для правильного течения беременности.Вы можете купить пакет на рынке Медонет.
Дефицит электролитов вызывается:
- физические нагрузки (тяжелая работа, спорт), когда тело интенсивно потеет,
- диарея и рвота
- употребление слишком малого количества жидкости,
- строгая диета,
- заболевания с высокой температурой
- прием мочегонных и слабительных средств.
Проверьте уровень электролитов в организме, выполнив тест в упаковке для женщин - Проверка здоровья женщины - диагностические анализы крови или для мужчин - Профилактические анализы крови для мужчин.
Электролиты заменены на:
- вода питьевая, в том числе высокоминерализованная,
- пить томатный сок,
- употребление в пищу продуктов, богатых калием, кальцием и магнием (соли, т.е. натрия, мы обычно поставляем организму слишком много),
- употребление изотонических напитков (на самом деле это питьевые электролиты),
- прием минералов в таблетках.
Проверка уровня электролита
Часто недомогание объясняется дефицитом электролитов. Однако, чтобы знать наверняка, нужно провести исследование. Это называется ионограммой и представляет собой тест концентрации электролитов. Их проводят при подозрении на нарушение водно-электролитного баланса организма. Для этого нужно будет сдать кровь как при общем анализе крови.
В большинстве случаев их проводят в условиях стационара. Их проводят утром и натощак, примерно через 12 часов после последнего приема пищи. Благодаря этому тесту можно определить уровень электролитов и, таким образом, подобрать соответствующий состав регидратационных препаратов.
Стоит регулярно проверять уровень электролитов, особенно если вы хотите посетить диетолога или улучшить обмен веществ. На рынке Медонет вы найдете Предконсультационные тесты у врача-диетолога - домашний анализ крови или Проверьте свой метаболизм - анализы крови.Благодаря этому исследованию вам будет легче подобрать подходящую для вас диету.
Электролиты - стандарты
Правильная концентрация электролита:
- натрий: 135-145ммоль/л,
- калий: 3,5-5,5 ммоль/л,
- кальций: 2,25-2,75 ммоль/л,
- магний: 0,65-1,2ммоль/л.
Стоит позаботиться о том, чтобы не привести к дефициту электролита.В ситуациях, когда организм теряет много воды (тепло, усилие, болезнь), организм нуждается в большом количестве жидкости. Также стоит уделять достаточно времени сну (от 7 до 8 часов), чтобы наш организм мог восстановиться и отдохнуть.
Помните, что не следует основывать свой рацион на низкокалорийных диетах или использовать голодание, потому что таким образом вы можете привести к ситуациям, опасным для нашего здоровья.
К продуктам, богатым электролитами, относятся: фрукты (бананы, киви, грейпфрут, авокадо), овощи (помидоры, картофель), сардины, молоко, творог, йогурт, пахта, цельнозерновой хлеб, миндаль, цитрусовые, гречка, овсяные хлопья, фундук, сушеный инжир, курага, кокосовая вода, томатный сок, минеральная вода, изотоник, тыквенные семечки, какао и шоколад.
Стоит отметить, что овощи и фрукты содержат много воды, например, в огурцах и помидорах ее около 95%.
Проверьте не только уровень электролитов в организме, но и другие важные для здоровья параметры в Пакете профилактических осмотров - анализы крови. Вы можете купить его на рынке Медонет. Если вы мужчина, вам также следует проверить, например, уровень тестостерона и маркер ПСА. Вы можете выполнить все эти тесты в пакете «Основные исследования для мужчин — анализы крови».
Электролиты - история
Открытие электролитов принадлежит Сванте Аррениусу, шведскому химику и физику, разработавшему теорию электролитической диссоциации, т.е. процесса распада химических соединений на ионы. Раствор, полученный в процессе диссоциации, называется электролитом. За это открытие шведский химик был удостоен Нобелевской премии по химии в 1903 году.
Нужно ли нам больше электролитов, если мы много потеем?
Когда мы потеем, мы теряем воду и электролиты, особенно натрий и хлорид.В результате длительные упражнения или физическая активность, особенно в жаркую погоду, могут привести к значительной потере электролитов. Подсчитано, что пот содержит в среднем от 40 до 60 миллимолей натрия на литр. Однако фактическое количество электролитов, теряемых с потом, может варьироваться от человека к человеку.
Например, в Соединенных Штатах максимально рекомендуемое потребление натрия составляет 2300 мг в день, что эквивалентно 6 граммам или 1 чайной ложке поваренной соли. Поскольку примерно 90% взрослых американцев потребляют значительно больше натрия, большинству людей не нужно возмещать потерю натрия с потом.Тем не менее, некоторые группы людей, такие как спортсмены, которые тренируются более двух часов, или те, кто тренируется в сильную жару, могут рассмотреть возможность употребления обогащенных электролитом спортивных напитков, чтобы компенсировать свои потери.
Мы также рекомендуем пищевую добавку Litoxen Xenico в форме растворимых таблеток. Препарат доступен на Медонет Маркет в наборе 1+1.
Для всех остальных достаточно получать нормальное количество натрия из пищи и питьевой воды, чтобы поддерживать надлежащую гидратацию.
90 122Электролиты необходимы для правильного функционирования организма. Их дефицит может привести к серьезным осложнениям как у взрослых, так и у детей...
Татьяна НаклицкаяГастролит представляет собой пероральный препарат, который при растворении в воде принимается для предотвращения или лечения легкого обезвоживания...
Флорактин — диетический препарат для специальных медицинских целей.Он выпускается в виде пероральных капель, капсул и саше. Снижает риск ... 9000 3
Литорсал Здровит – биологически активная добавка в виде шипучих таблеток, предназначенная специально для людей, ведущих активный образ жизни. Продукт помогает сохранить ...
Humana Electrolyte — препарат, используемый для предотвращения обезвоживания и лечения обезвоживания при диарее.После приема внутрь препарат дополняли … 9000 3 депутат
Галлюцинации, чудеса и фантасмагории — это не сказочные творения, придуманные для книг, фильмов и фантастических рассказов.Иногда это наше тело...
Электролиты, обнаруженные в биологических жидкостях нашего организма, представляют собой водные растворы ионов, наделенных электрическим зарядом (катион — заряд...
Kalipoz prolongatum — это лекарство, отпускаемое по рецепту, используемое для лечения дефицита калия.Выпускается в виде таблеток пролонгированного действия. Из Калипоза... 9000 3
Электролиты - химический состав, свойства, последствия дефицита, источники, противопоказания
Электролиты - химический состав
Электролиты представляют собой группу соединений, состоящих из элементов, также известных как ионы солей. Они обнаруживаются в крови, плазме и тканевых жидкостях. Наиболее важные из них:
- натрий – в виде положительных ионов, его высокая концентрация проявляется повышенной жаждой,
- кальций – отвечает за проводимость в нервной системе и мышечные сокращения,
- калий – поддерживает работу сердечно-сосудистой системы,
- магний – влияет на процесс сокращения сердечной мышцы и правильное течение обмена веществ.
Внеклеточная жидкость также содержит анионов хлорида , которые регулируют концентрацию натрия и влияют на секрецию желудочного сока.
Чек : Соль магния – свойства и применение
Электролиты - свойства
Присутствие электролитов в организме человека влияет на:
- управление водными ресурсами в организме - отвечает за распределение воды по системе и ее поглощение; соответствующий уровень ионов натрия позволяет поддерживать нужное количество воды как в межклеточных пространствах, так и в самих клетках благодаря осмосу;
- функционирование нервной системы - передача информации между нервными клетками; ионы натрия, путешествуя по нейрону, стимулируют другую клетку, приводя к так называемомуэлектрическое возбуждение;
- кислотно-щелочной баланс - оптимальный рН для организма находится в пределах 7,35-7,45, благодаря электролитам удается поддерживать стабильную слабощелочную среду; слишком сильное отклонение от указанных значений может привести к опасному состоянию: ацидозу или алкалозу;
- мышечная система - ионы кальция поддерживают сокращения мышц, благодаря чему возможно их движение, а ионы магния расслабляют мышцы после тренировки.
Выписка : Закисление организма - правда или миф?
Как восполнить электролиты?
Для восполнения дефицита электролитов, прежде всего, пейте много высокоминерализованной воды. Дефицит калия можно легко исправить, употребляя томатный сок, ценный источник калия, а также бананы и курагу. Диета, содержащая тыквенные семечки, какао и миндаль, пополнит ваш уровень магния.
Также на рынке доступны готовые питьевые электролитные смеси , а также минералы в таблетках. Во время активности спортсмены должны регидратировать себя изотоническими напитками, содержащими хлорид натрия и калия. Сон также является важным фактором в поддержке регенерации организма.
Электролиты - последствия дефицита
Дефицит электролита очень распространен и может привести к обезвоживанию организма.Электролитный баланс часто нарушается при чрезмерных физических нагрузках, рвоте или диарее. Недостаточное количество ионов солей вызывает колебания артериального давления, нерегулярное сердцебиение, тремор и онемение конечностей, слабость и сонливость, мышечные судороги.
Читать : Как избежать обезвоживания и гипергидратации?
Электролиты и гипертония
Лекарства, принимаемые людьми с высоким кровяным давлением, выталкивают накопленную воду из организма, чтобы уменьшить давление на ткани.Однако следует помнить, что при частом мочеиспускании вымываются многие ценные питательные вещества (в том числе магний и калий), которые особенно важны для правильной работы сердца. Поэтому людям, борющимся с гипертонией, следует чаще проверять уровень электролитов в крови и восполнять их возможный дефицит.
- Травы для снижения артериального давления. Ученые выяснили, как они работают
Электролиты и диабет
Некоторые ионы солей являются важным компонентом в регуляции секреции инсулина.Так, у больных сахарным диабетом существует связь между нарушениями углеводного обмена и нарушениями водно-электролитной системы , которые в основном сопровождают гипергликемию. Неиспользованная глюкоза перемещает жидкости и их электролиты из клеточного пространства во внеклеточное, что нарушает баланс организма и может привести к серьезному дефициту калия, известному как гипокалиемия. Поэтому очень важно принимать правильное количество ионов, а в случае дефицита использовать соответствующие добавки.
См. : Диабетическая диета. Как правильно питаться при сахарном диабете?
Электролиты для спортсменов
Во время интенсивных и регулярных физических упражнений вместе с потом организм избавляется от скопившейся воды и важных солевых ионов, то есть электролитов . Для спортсменов особенно важно обеспечить адекватное поступление ценных ингредиентов при поддержании надлежащего водно-электролитного баланса.
Потерянную жидкость следует потреблять в традиционной форме в виде воды , доставляя ее в организм небольшими глотками, тогда эффективность гидратации возрастает. Однако оказывается, что воды часто бывает недостаточно и при интенсивных физических нагрузках стоит поддерживать организм готовой смесью электролитов, которая восполнит запасы минералов и снизит риск обезвоживания.
- Гималайская соль, морская соль или поваренная соль? Который лучший?
Электролиты для пожилых людей
Правильная гидратация необходима для поддержания здоровья ваших внутренних органов и хорошего самочувствия.Несмотря на это, многие пожилые люди имеют большие проблемы с правильной дозой потребления жидкости. Из-за снижения аппетита у пожилых людей также снижает частоту ощущения жажды , что может оказаться очень опасным для здоровья.
Читать: Старший Сейм. Проблемы питания пожилых людей 9000 5
Болезни мочевыводящих путей также способствуют тому, что пожилые люди намеренно уменьшают поступление жидкости в организм, чтобы избавиться от стойких недугов, например.боль при мочеиспускании. У пожилых людей недостаток адекватной гидратации может иметь немедленные последствия, такие как общее ухудшение самочувствия, недостаток концентрации и энергии.
Поэтому в случае, если пожилой человек не в состоянии выпивать суточную норму воды, используйте смеси для гидратации , которые помогут восполнить дефицит и избавиться от стойких последствий обезвоживания.
Электролиты - количественный анализ и стандарты
При подозрении на водно-электролитное расстройство используется тест под названием , известный как ионограмма .Это очень быстро, и достаточно собрать венозную кровь как для обычного анализа крови. В базовом тесте измеряются только калий и натрий, но есть возможность расширить тест дополнительными параметрами. Результат получается в виде количества проверенных ионов в данной единице измерения и для отдельных минералов должен быть следующих значений:
- натрий: 3250 мг/л,
- калий: 156 мг/л,
- магний: 24 мг/л,
- кальций: 100 мг/л.
Ионограммы чаще всего делают в условиях стационара, чтобы правильно подобрать состав ирригационной смеси для больного.
Хотите проверить уровень электролитов в крови? Решите проанализировать уровень калия, кальция, магния и натрия, заказав лабораторные тесты, доступные на платформе Medonet Market.
Электролиты во фруктах и овощах
Электролиты – это не только БАДы в виде готовых смесей, регулирующие водный баланс организма.Фрукты и овощи являются отличным источником питательных веществ, а также способом избежать обезвоживания.
Помидоры или томатный сок, бананы и картофель богаты калием. Магний содержится в шпинате, капусте и бобах, а сушеный инжир и брокколи содержат кальций. Салат и оливки восполняют недостаток хлоридов. Поэтому включение этих продуктов в свой ежедневный рацион предотвратит обезвоживание и обеспечит хорошее самочувствие.
Читайте также : 10 самых полезных польских овощей
Электролиты и спирт
Общеизвестным последствием чрезмерного употребления алкогольной продукции является т.н.Похмелье. Отравление алкоголем очень часто проявляется тошнотой, головной болью, дрожью в руках и общей слабостью организма, связанной с обезвоживанием. Алкоголь нарушает гормональную регуляцию, поэтому диурез также связан с потерей воды и полезных минералов. Для уменьшения тягостных симптомов похмелья следует интенсивно орошать организм негазированной водой и принимать порцию вымытых электролитов . В этом случае подойдут свежие фрукты и овощи, а также готовые препараты для регидратации, доступные в аптеках.
Проверьте : Алкоголь, вызывающий сильнейшее похмелье
Электролиты и пищевые отравления
Пищевое отравление вызывает рвоту или диарею, что приводит к потере воды и вымыванию натрия, калия и глюкозы. Самое главное не обезвоживать организм, так как это может закончиться пребыванием в больнице. Следовательно, вам следует пить много жидкости, чтобы восполнить недостаток.В связи с тем, что при желудочных недугах жажда не дает о себе знать, стоит потянуться за электролитами, чтобы быстро поставить измученный организм на ноги.
Электролиты и изотонические напитки
Человек начинает испытывать жажду, когда уровень обезвоживания достигает 1,5%. Вот почему пить жидкости так важно задолго до этой реакции. Люди, регулярно занимающиеся спортом, должны обратить на это особое внимание.Физически активные люди часто употребляют напитки, содержащие помимо электролитов углеводы, так называемые изотонические напитки.
- Йерба мате - виды, свойства, способ заваривания. Как пить йерба мате?
В отличие от электролитов и воды, изотонические напитки добавляют энергию, которая является дополнительным топливом для использования во время тренировки. Однако для людей, соблюдающих диету для снижения веса, рекомендуются классические препараты электролитов, которые не добавляют лишних калорий в рацион, насыщают организм ценными ингредиентами и поддерживают оптимальный уровень гидратации.
Электролиты - противопоказания
Несмотря на то, что состав смесей электролитов прост и содержит вещества, естественным образом присутствующие в организме, существуют противопоказания к употреблению этого типа пищевых добавок. Их не следует применять пациентам, принимающим диуретики и страдающим циррозом печени. Кроме того, люди, чувствительные к некоторым компонентам препарата, должны тщательно изучить состав электролитной смеси перед ее употреблением.
Электролиты – на что обратить внимание при покупке готовой смеси?
Перед покупкой электролитов в аптеке следует узнать об их составе. Очень часто можно встретить препараты, имеющие в своем составе дополнительные, совершенно ненужные элементы. Биологически активная добавка должна иметь короткий, простой состав без искусственных подсластителей, ароматизаторов или красителей.
Также важно, чтобы компоненты электролита обладали наибольшей биодоступностью, т.е.цитраты. На упаковке должна быть информация об осмолярности продукта. Гипоосмотические растворы обязательно рекомендуются, если есть риск обезвоживания.
Вы ищете препараты с электролитами? В «Медонет Маркет» вы можете заказать пищевую добавку с цитратом кальция и витамином D или таблетки с цитратом магния.
Электролиты – важная составляющая рациона
Электролиты представляют собой группу элементов, чрезвычайно важных для правильного функционирования всего организма.Стоит позаботиться о водно-электролитном балансе, введя в свой ежедневный рацион минимум 1,5 литра жидкости в виде негазированной воды и фруктов и овощей, которые восполнят дефицит таких ионов солей, как кальций, калий, магний, натрий и хлориды.
Читайте также : Щелочная вода и ее свойства. Виды, отзывы и покупки
Люди, регулярно занимающиеся спортом, страдающие гипертонией, диабетом, диареей и рвотой, должны обратить особое внимание на дополнительный прием регидратирующих препаратов, содержащих электролиты.Поддерживая правильный баланс между элементами, можно существенно повлиять на самочувствие и правильное функционирование мышечной системы, нервной системы, сердца, а также поддерживать оптимальный рН организма.
Содержание веб-сайта medonet.pl предназначено для улучшения, а не для замены контакта между Пользователем веб-сайта и его врачом. Сайт предназначен только для информационных и образовательных целей. Прежде чем следовать специальным знаниям, в частности медицинским советам, содержащимся на нашем Веб-сайте, вы должны проконсультироваться с врачом.Администратор не несет никаких последствий, вытекающих из использования информации, содержащейся на Сайте. Нужна консультация врача или электронный рецепт? Зайдите на halodoctor.pl, где вы получите онлайн-помощь - быстро, безопасно и не выходя из дома. 90 203 90 200
Источники- Дзенишевский Ю., Диарея В., Диетология. Питание, питание в профилактике и лечении, -е изд.наука. М. Ярош, Институт продуктов питания и питания, Варшава, 2016–2017 гг., стр. 252–265.
- https://journals.viamedica.pl/folia_cardiologica/article/view/68553 [по состоянию на 12 мая 2021 г.]
- https://pantabletka.pl/elektrolity-jak-wybrac-najlepsze-opinia-analiza/ [дата обращения: 05.12.2021]
- Мзирай М., Сепсиак М., Журальская Р., Модлинская А., Домагала П., Вода – важное питательное вещество в питании пожилых людей 90 200, «Проблемы гигиены и эпидемиологии» 2017, т. 2, с.2, № 98, стр. 118-124.
Электролиты - что это такое, как распознать их дефицит и как восполнить?
Электролиты необходимы для правильного функционирования организма. Однако многие люди не знают, на что именно они влияют, в каких процессах участвуют и в чем может заключаться их недостаток. Что такое электролиты и почему поддержание их надлежащего уровня в организме так важно для здоровья?
Электролиты - что это такое?
Электролиты – это ионы солей, содержащиеся в жидкостях нашего организма – крови, плазме и тканевых жидкостях.Они принимают участие во многих процессах, происходящих в организме – влияют на работу головного мозга, мышц и других органов, позволяют поддерживать правильный водно-электролитный баланс, а также поддерживают напряжение в клеточных мембранах и отвечают за проведение электрических импульсов. импульсы через нейроны к другим клеткам.
Какова роль электролитов в организме?
Наиболее важные электролиты включают: натрий, кальций, магний и калий. Все они играют определенные роли, от которых зависит правильное функционирование нашего организма.
| Электролиты | Функция в корпусе |
| Натрий | Наиболее активный осмотически компонент межклеточной жидкости. Натрий является основным катионом, участвующим в поддержании надлежащей гидратации организма. |
| Кальций | Принимает участие в испытании проведения электрических импульсов в нейронах и отвечает за его регуляцию. |
| Магний | Имеет решающее значение для обеспечения правильное функционирование нервной и мышечной систем и правильное течение метаболические процессы. |
| Калий | Поддерживает поддержание артериального давления на должном уровне и поддерживает работу сердца и мышц. |
Хлориды также часто включают в группу наиболее важных электролитов.Это многочисленные анионы в организме, которые важны для поддержания кислотно-щелочного баланса и поддержки выработки соляной кислоты в желудке.
0 0
0 0
0 0
0 0
0 0
0 0
0 0
0 0
0 0
0 0
5.00 1
0 0
0 0
0 0
0 0
0 0
Дефицит электролитов. Симптомы и последствия
Аномальные уровни электролитов могут привести к нарушениям в функционировании организма.Однако их потери трудно избежать. К ней приходит, в частности, в жаркую погоду - в жаркую погоду тело потеет и вместе с ним организм теряет электролиты. Тот же механизм работает и в случае физических нагрузок — напряженной работы или интенсивных тренировок.
Мы также теряем электролиты при вирусных инфекциях и других заболеваниях, сопровождающихся лихорадкой. Их дефицит также может быть вызван рвотой и диареей. Снижение электролитов в организме также является следствием алкогольной диареи.Другие причины дефицита электролитов включают строгую диету, употребление слишком малого количества жидкости и прием мочегонных и слабительных средств.
Как в организме проявляется дефицит электролитов? Наиболее распространенными симптомами аномального уровня электролитов являются:
90 112 90 113 тремор и мышечные спазмы, 90 114 90 113 отеки, 90 114 90 113 диарея или запор, 90 114 90 113 тошнота, головная боль, 90 114 90 113 сонливость, слабость и быстрая утомляемость, 90 114 90 113 ухудшение самочувствия, нервозность.Дефицит электролитов в организме может привести к расстройствам нервной системы и повышению артериального давления. В более серьезных случаях это может привести к обмороку, судорогам, сердечной дисфункции, хрупкости костей и параличу. Обезвоживание также является очень опасным последствием дефицита электролитов.
Как проверить концентрацию электролита в организме?
Для проверки уровня электролитов в организме делают ионограмму.Этот тест проводится людям, у которых подозреваются нарушения водно-электролитного баланса. Поводом для проведения ионограммы также могут быть отеки, нерегулярное артериальное давление или нарушение сердечного ритма.
Соответствующая концентрация электролитов в организме составляет:
90 112 90 113 натрия - 135-145 ммоль/л, 90 114 90 113 кальция - 2,25-2,75 ммоль/л, 90 114 90 113 магния - 0,65-1,2 ммоль/л ,Как долить электролиты?
Электролиты можно легко дополнить, благодаря чему риск дефицита и, следовательно, его опасные для здоровья последствия будут намного меньше.В первую очередь рекомендуется регулярно пить воду, в том числе высокоминерализованную, и томатный сок, которые являются богатым источником калия. Также стоит позаботиться о своем рационе и дополнить его продуктами, содержащими натрий, кальций, магний и калий, в том числе томатами, бананами, курагой, тыквенными семечками и миндалем. В свою очередь, во время тренировки следует употреблять изотонические напитки, обогащенные электролитами.
Прием пищевых добавок также является хорошим способом пополнения запасов электролитов. Большой популярностью пользуются электролиты в пакетиках, содержащие порошок для приготовления питьевого раствора.Популярные продукты часто содержат подсластители и ароматизаторы, делающие напиток приятным на вкус — это важно, например, при даче электролитов детям. В дополнение к электролитам в пакетиках существуют также добавки в виде шипучих таблеток для растворения в воде. Чтобы предотвратить появление симптомов дефицита электролитов, и в то же время поддерживать работу ключевых для организма органов, вы также можете использовать добавки для сердца и системы кровообращения.
Как избежать дефицита электролитов?
Стоит знать не только как восполнить электролиты, но и как избежать их дефицита.В первую очередь нужно не забывать обеспечивать организм нужным количеством жидкости – особенно в жаркую погоду, при болезни, поносе или при физических нагрузках. При очень высоких температурах физические упражнения и тренировки следует по возможности ограничить. Также не рекомендуется резко менять свой рацион.
Электролиты – это ионы солей, необходимые для хорошего здоровья. Их надлежащий уровень определяет водно-электролитный баланс, а также работу нервной, мышечной и кровеносной систем, а значит – правильное функционирование всего организма.
.Электролит аккумуляторной батареи - уровень электролита

Обычно осенне-зимний сезон показывает состояние автомобильных аккумуляторов. Кислота, используемая в автомобильных аккумуляторах, является электропроводной и незаменима в автомобиле. Однако со временем уровень электролита в аккумуляторах уменьшается, и может потребоваться его доливка. Почему это происходит? Как правильно заполнить полость? Как регенерировать старый аккумулятор? Прочтите нашу статью и узнайте ответы!
Какая кислота в аккумуляторе?
Новые аккумуляторы содержат раствор серы в качестве электролита. Что такое аккумуляторный электролит? Это раствор, обладающий способностью проводить электричество. Его присутствие внутри автомобильного аккумулятора необходимо для того, чтобы он мог генерировать и передавать ток определенного напряжения и силы. Поэтому в течение многих лет эксплуатации стоит проверять уровень электролита и доливать его. Однако это относится не ко всем типам аккумуляторов.
Сколько электролита содержится в батарее?
Обычно мотоциклетные аккумуляторы содержат аккумуляторный электролит в комплекте, который необходимо залить перед первым использованием. Вопросов о емкости нет. Емкость с электролитом заполняется до уровня, соответствующего размеру аккумулятора. Бывает, однако, что неизвестно, сколько электролита следует долить в аккумулятор. Сумма должна определяться уровнем раскрытия плиток или отметками.

Электролит для автомобильных аккумуляторов - как дополнить?
Аккумуляторный электролит никогда не доливается полностью. Почему? При его зарядке вода испаряется и вещество уменьшается в объеме.Так что если есть возможность добавить его в батарею, делайте это в количестве на 5 мм выше уровня пластин. Для этого используйте твист-офф ячейки, которые используются для заполнения пробелов в растворе. В вашем аккумуляторе есть минимальный и максимальный уровень электролита? Используйте эти весы и используйте дистиллированную воду.
Серная кислота для аккумулятора? Чем восполнить пробелы?
Если вы хотите правильно использовать устройство, следуйте инструкциям производителя. Конечно, он включил информацию о том, какое вещество восполняет недостаток электролита в аккумуляторах. В подавляющем большинстве случаев регенеративные свинцово-кислотные аккумуляторы можно доливать дистиллированной/деминерализованной водой. Электролит для этой цели не используется.

Аккумуляторная кислота и заправка – почему деминерализованная вода?
В аккумуляторе есть электролит. Проще всего было бы купить его и залить внутрь. Это звучит логично, но не рекомендуется.Когда уровень электролита падает, пластины аккумулятора оголяются, в результате чего они покрываются сульфатом свинца. Добавление электролита в батареи вместо дистиллированной воды повысит плотность электролита выше нормы. В случае с быстроразряжающимся устройством лучше всего проводить регенерацию, если батарея сервисного типа.
Как регенерировать засульфатированный автомобильный аккумулятор?
Аккумуляторный электролит может обжечь кожу и дыхательные пути, поэтому важно также иметь хорошо проветриваемое помещение.
Что для этого нужно? Вам понадобится
- вода деминерализованная;
- электролит для аккумуляторов;
- выпрямитель с регулировкой силы тока;
- аккумулятор, в который можно заливать раствор.

А как регенерировать батарею в домашних условиях?
- Подготовьте средства защиты глаз, рук и органов дыхания.
- Осторожно слейте раствор серы из батареи.
- Замените электролит батареи дистиллированной водой на 5 мм выше пластин.
- Ежедневно подсоединяйте зарядное устройство к аккумулятору с током менее 4 А.
- После зарядки аккумулятора слейте раствор и наполните его дистиллированной водой.
- Перезагрузить как в пункте. 4.
- Отсоедините аккумулятор, слейте раствор и залейте электролит.
- Зарядите небольшим током и готово.
Плотность электролита в заряженном устройстве 1,28 г/см3, проверить это можно ареометром.
Где купить аккумуляторный электролит Сводка
В вашем распоряжении множество предложений интернет-магазинов и магазинов канцтоваров. При обслуживании и регенерации использованных аккумуляторов лучше запастись более чем 1 литром серной кислоты. Сумма, которую вам придется заплатить за 5-литровый бак электролита для мотоциклетных и автомобильных аккумуляторов, не должна превышать 30-35 злотых. Помните, однако, что при добавлении веществ в серную кислоту, находящуюся в аккумуляторе, используется ТОЛЬКО дистиллированная вода!
 .
.Дефицит электролитов – как распознать и предотвратить? • Фельдшер
Вы наверняка знаете, что в вашем рационе должно быть много магния, натрия, кальция и калия. Вы когда-нибудь задумывались, как эти элементы влияют на функционирование вашего тела? Что такое дефицит электролитов? Узнайте, в каких процессах участвуют электролиты и почему так важно регулярно увлажнять организм.
Какова роль электролитов в вашем организме?
Термин электролиты охватывает элементы, хорошо знакомые вам по урокам химии.Хотя организм нуждается в них в очень малых количествах, их присутствие имеет решающее значение для здоровья. От них зависит, как будет функционировать водно-электролитный баланс организма. Влияют на работу сердца, головного мозга и, прежде всего, на передачу импульсов в нервной системе .
Какие электролиты нужны организму?
Электролиты, в которых нуждается ваше тело:
- натрий - важнейший компонент плазмы, он определяет правильное кровяное давление и поддержание осмотического баланса; вместе с калием влияет и на проведение нервных импульсов;
- калий – действует противоположно натрию – уменьшает количество внеклеточной жидкости, дополнительно регулирует рН клеток и, самое главное, отвечает за правильные сокращения сердечной мышцы;
- кальций – помимо того, что он является важным строительным материалом для костей и зубов, он влияет на процесс свертывания крови;
- магний – действует аналогично кальцию, а также отвечает за протекание метаболических процессов – является катализатором многих ферментов;
- Отрицательно заряженные ионы хлора и фосфата, контролирующие водно-электролитный баланс и отвечающие за кислотно-щелочной баланс в организме.
Это низкий уровень электролитов в вашем организме? Знайте характерные симптомы!
Симптомы могут быть трудно распознать при отсутствии электролитов, особенно если обезвоживание сопровождается инфекцией или диареей. Первый сигнал, который должен вас насторожить – это постоянное чувство жажды и сухость во рту. Если вы не соблюдаете водный режим, у вас могут развиться дополнительные симптомы, связанные с дефицитом электролитов :
- мышечные спазмы и боли;
- аритмии и скачки давления;
- чувство слабости;
- отек конечностей;
- тошнота и головокружение;
- диарея.
Если вы подозреваете, что у вас постоянный дефицит электролитов, обратитесь к врачу. Затем он может заказать ионограмму — тест, который проверяет уровень отдельных ионов в организме.
Когда дефицит электролитов наиболее распространен?
Бывают ситуации, когда трудно предотвратить чрезмерную потерю электролита. В основном речь идет о высоких температурах и занятиях спортом – тогда вместе с потом из организма выводятся ценные элементы.К счастью, такие случаи не опасны. У здоровых людей уровень электролитов в организме можно легко восполнить.
Причины дефицита электролитов
Низкий уровень электролитов может быть более серьезным, вызванным болезнью или неправильным образом жизни. Наиболее распространенные причины электролитного дефицита: :
- болезни органов пищеварения, сопровождающиеся рвотой или диареей;
- употребление алкоголя - симптомы т.н. похмелье на следующий день связано с обезвоживанием;
- использование некоторых лекарственных средств с мочегонными побочными эффектами;
- ограничительные диеты с низким содержанием питательных веществ, содержащие электролиты;
- инфекции с высокой температурой.
Как быстро долить электролиты?
Нет необходимости ежедневно следить за уровнем электролитов в организме. Люди, которые едят богатую, разнообразную пищу и пьют много воды, могут быть уверены, что количество калия, кальция и магния в их организме соответствует норме. Как мне получить магний, кальций, калий, натрий до нужного уровня? Лучшее средство — просто… пить воду. Это может быть минеральная вода с высокой степенью минерализации, но подойдет и обычная водопроводная вода.Его не следует фильтровать — с некоторыми фильтрами этот процесс удаляет ценные ионы из фильтра.
Что делать, если питьевой воды недостаточно?
При более сильном обезвоживании питьевой воды может не хватить (хотя отказываться от обильного питья тогда не стоит). В таких ситуациях стоит использовать регидратационные жидкости. Дефицит электролитов восполняется водорастворимыми пакетиками, содержащими легкоусвояемые ионы и глюкозу. Особое внимание следует уделять восполнению электролитов в жаркую погоду и во время физических упражнений .Помимо большого количества воды, стоит употреблять изотонические напитки. Это не обязательно должны быть продукты из магазина – такой напиток можно легко приготовить самостоятельно. В воду добавляют лимонный сок, мед и щепотку соли
.Дефицит электролитов может отрицательно сказаться на самочувствии и здоровье. Вот почему так важно избегать обезвоживания. Вы также можете ежедневно предотвращать нехватку электролитов и связанные с ней симптомы. Главное здесь – соблюдать правильную диету, содержащую продукты, богатые натрием, магнием, кальцием и калием: помидоры, миндаль, бананы, тыквенные семечки, курагу.
См. также: .
электролитов | Apteka Moderna
Электролиты
Электролиты
Электролитами принято называть группу из четырех важных биоэлементов – натрия, калия, кальция и магния. Водно-электролитный баланс является одним из важнейших параметров поддержания здоровья организма. Как избыток, так и недостаток электролитов могут иметь неприятные последствия для здоровья, что часто заставляет нас следить за их концентрацией.
Электролиты - что это такое?
Все четыре упомянутых элемента растворяются в воде, которая составляет более 50% веса взрослого человека. В то время как электролиты не обеспечивают измеримой энергии, питательные вещества распознаются. Водорастворимые электролиты могут быть обнаружены внутри клеток, межклеточных пространств, кровеносных сосудов и даже в спинномозговой жидкости, жидкости, заполняющей камеры глаза, плевральной и перикардиальной жидкостях, пищеварительных соках.Задачей электролитов является, прежде всего, адекватное осмотическое давление, являющееся необходимым условием протекания большинства метаболических процессов.
Электролиты и их роль в организме
Натрий является основным компонентом плазмы, поддерживает адекватный объем жидкости в организме и оказывает прямое влияние на величину артериального давления. В микромасштабе натрий регулирует поток воды «в клетки и из них», увеличивая или уменьшая осмотическое давление. Калий, в свою очередь, является электролитом , , который играет огромную роль в нервно-мышечной проводимости и отвечает за правильный ход сокращения всех мышечных клеток, присутствующих в организме, включая клетки сердечной мышцы.Кальций участвует в процессе формирования и минерализации костей. Он также играет важную роль в процессе свертывания крови. Магний также участвует в минерализации костей, точно так же, как кальций участвует в свертывании крови и влияет на сокращение сердечной мышцы.
Электролиты и их колебания
В дополнение к их важной физиологической роли , электролиты также играют диагностическую роль. Колебания уровня электролитов могут свидетельствовать о заболеваниях почек, диабете, эндокринных заболеваниях, гиперпаратиреозе и онкологических заболеваниях, головных болях, раздражительности и мышечной слабости.Дефицит калия, с другой стороны, вызван хроническим использованием диуретиков при лечении гипертонии (фуросемид, индапамид, гидрохлоротиазид). Гипокалиемия характеризуется запорами, повышенным артериальным давлением, болезненными мышечными сокращениями и сердечными аритмиями. Снижение уровня кальция может создавать риск развития приступов тетании, вызывать нарушения зрения и бронхоспазм.
Безрецептурные электролиты из аптеки - стоит ли?
Поставка электролитов с фармацевтическими препаратами имеет логическое обоснование.Мы пьем слишком мало - это скорее подслащенные и горячие жидкости, а не чистая вода.Большинство из нас выпивают всего 1,20 литра жидкости в день. Прием дополнительной дозы электролитов также рекомендуется людям с длительной диареей и тем, кто занимается интенсивными видами спорта.
Электролиты без рецепта - как использовать?
Если вы хотите восполнить электролиты, стоит приобрести готовые препараты ОРС (раствор для пероральной регидратации) или провести гидратацию самостоятельно.Правильный состав электролита ОРС- безрецептурной жидкости является предпосылкой успешного орошения. Поэтому его нельзя разбавлять, подслащивать или добавлять в какие-либо соки. Растворы лучше всего подавать охлажденными, небольшими порциями и через короткие промежутки времени. Ежедневно важно помнить о соответствующем снабжении минеральной водой, которая имеет правильно сбалансированный состав катионов и анионов. Водный баланс не должен включать такие жидкости, как чай, которые из-за термической обработки считаются безэлектролитными жидкостями.
.Электролиты что это такое и как дополнить
Электролиты – вещества, способные проводить электричество. В организме человека диссоциируют соли натрия, калия, хлора, кальция и магния. Это означает, что эти соединения распадаются на ионы в водном растворе. Основным катионом внеклеточного пространства является натрий, а анионом – хлорид. Во внутриклеточной жидкости основную роль играет катион калия, а наиболее важными анионами являются фосфаты и протеинаты.Эти соединения отвечают за поддержание гомеостаза [1]. В этой статье вы узнаете о характеристиках отдельных электролитов и показаниях к их приему.
СОДЕРЖАНИЕ
- Demand for selected electrolytes
- Food sources
- Characteristics of selected electrolytes
- Sodium
- Potassium
- Magnesium
- Calcium
- Chlorine
- Electrolyte disturbances
- 10 Dehydration 9-Electrolyte disturbances
- 10 Dehydration
- -Electrolyte нарушения спорт
- Электролиты, сухой воздух и высокогорный климат
- Резюме
Спрос на отдельные электролиты
В таблице ниже показаны стандарты, определяющие требования к выбранным элементам.Они касаются здоровых людей в возрасте 19-50 лет. Представленные значения не распространяются на население, занимающееся профессиональным спортом.
Нормы натрия, калия и хлора установлены на основе достаточного потребления (Al). Напротив, магний и кальций определяются в соответствии с рекомендуемой диетической нормой (RDA-Recommended Dietary Allowances). Потребность в поваренной соли чаще встречается в случае с натрием.
Таблица 1. Стандарты некоторых электролитов для взрослых

| Element | Type of standard | Normal in women | Normal in men |
| Sodium (mg) | AI | 1500 | 1500 |
| Potassium (mg) | AI | 3500 | 3500 |
| Chlorine (mg) | AI | 2300 | 2300 |
| Magnesium (mg) | RDA | 400 | 310 |
| Calcium (mg) | RDA | 1000 | 1000 |
Источник: Jarosz M, Rychlik E, Stoś K, Wierzejska R, Wojtasik A, Charzewska J et al.(2020) Стандарты питания для населения Польши: Институт пищевых продуктов и питания; 2017.
Пищевые источники электролитов
Таблица 2. Пищевые источники выбранных электролитов.
| Элемент | Пищевые продукты |
| Натрий | поваренная соль и продукты, содержащие ее: зерновые продукты, например, хлеб, мясные полуфабрикаты, например, мясное ассорти, молочные продукты, например, сычужный сыр, продукты высокой степени переработки, фаст-фуд |
| Калий | овощи (картофель составляет значительную долю в Польше), фрукты (особенно сушеные, бананы, дыни, авокадо), орехи и семена, бобовые, молоко и консервы, мясо, зерновые продукты, |
| Хлор | поваренная соль и продукты, ее содержащие |
| магний | сухие семена бобовых, какао и продукты, их содержащие, орехи, цельнозерновые злаки, жесткая питьевая вода, богатая магнием минеральная вода, напримерКрыничанка, Старополянка, Мушинянка, Магнезия |
| Кальций | молоко и молочные продукты, растительные напитки и продукты, обогащенные кальцием семена | 90 064 90 115 90 116
 Edward Olive / 123RF
Edward Olive / 123RF  sergiomonti / 123RF
sergiomonti / 123RF